1.(2020•浙江1月选考)设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法不正确的是( )
A.H2(g)+ O2(g)=H2O(l) ΔH=-286 kJ·mol−1,则每1 mol [H2(g)+ O2(g)]生成1 mol [H2O(l)]放热286 kJ
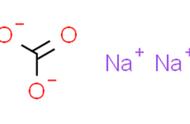
B.Cr2O72-+ne−+14H =2Cr3 +7H2O,则每生成1 mol Cr3 转移电子数为3NA
C.Al3 +4OH−=[Al(OH)4]−,说明1 mol Al(OH)3电离出H 数为NA
D.1 mol CO2与NaOH溶液完全反应,则n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol
【答案】C
【解析】A项,由热化学方程式可知,氢气在氧气中的燃烧为放热反应,1 mol [H2(g)+ O2(g)]生成1 mol [H2O(l)]放热286 kJ,故A正确;B项,由铬元素化合价变化可知,生成2 mol Cr3 转移6mol电子,则生成1 mol Cr3 转移电子数为3NA,故B正确;C项,氢氧化铝是两性氢氧化物,在溶液中发生酸式电离部分电离出氢离子,则1 mol Al(OH)3电离出H 数小于NA,故C错误;D项,由碳原子个数守恒可知,1 mol CO2与NaOH溶液完全反应生成的盐溶液中,n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol,故D正确;故选C。
2.(2020•浙江7月选考)NA为阿伏加德罗常数的值。下列说法正确的是( )
A.4MnO4- 5HCHO 12H =4Mn2 5CO2↑ 11H2O,1mol[4MnO4- 5HCHO]完全反应转移的电子数为20NA
B.用电解粗铜的方法精炼铜,当电路中通过的电子数为NA时,阳极应有32 g Cu转化为Cu2
C.常温下,pH=9的CH3COONa溶液中,水电离出的H 数为10−5NA
D.1 L浓度为0.100 mol·L−1的Na2CO3溶液中,阴离子数为0.100NA
【答案】A
【解析】A项,Mn元素的化合价由 7价降至 2价,则4mol MnO4-完全反应转移电子物质的量为4mol×[( 7)-( 2)]=20mol,即转移电子数为20NA,A正确;B项,电解精炼铜时,阳极为粗铜,阳极发生的电极反应有:比铜活泼的杂质金属失电子发生氧化反应以及Cu失电子的氧化反应:Cu-2e-=Cu2 ,当电路中通过的电子数为NA时,即电路中通过1mol电子,Cu失去的电子应小于1mol,阳极反应的Cu的物质的量小于0.5mol,则阳极反应的Cu的质量小于0.5mol×64g/mol=32g,B错误;C项,溶液的体积未知,不能求出溶液中水电离出的H 数,C错误;D项,n(Na2CO3)=0.100mol/L×1L=0.100mol,由于CO32-发生水解:CO32- H2O HCO3- OH-、HCO3- H2O H2CO3 OH-,故阴离子物质的量大于0.100mol,阴离子数大于0.100NA,D错误;故选A。
3.(2019•新课标Ⅱ卷)已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3g 3He含有的中子数为1NA
B.1 L 0.1 mol·L−1磷酸钠溶液含有的 数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3 转移的电子数为6NA
D.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
【答案】B
【解析】A项, 的中子数为3-2=1,则3g 的中子数为 =NA,A项正确; B项, 磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1L 0.1mol/L的磷酸钠溶液中磷酸根离子的个数小于1L×0.1mol/L×NA mol-1 =0.1NA,B项错误;C项,重铬酸钾被还原为铬离子时,铬元素从 6降低到 3,1mol重铬酸钾转移的电子数为3mol×2×NA mol-1 =6NA,C项正确;D项,正丁烷与异丁烷的分子式相同,1个分子内所含共价键数目均为13个,则48g正丁烷与10g异丁烷所得的混合物中共价键数目为 ×13×NA mol-1 =13NA,D项正确;故选B。
4.(2019•新课标Ⅲ卷)设NA为阿伏加德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是( )
A. 每升溶液中的H 数目为0.02NA
B.c(H )= c( ) 2c( ) 3c( ) c(OH−)
C.加水稀释使电离度增大,溶液pH减小
D.加入NaH2PO4固体,溶液酸性增强
【答案】B
【解析】A项,常温下pH=2,则溶液中氢离子浓度是0.01mol/L,因此每升溶液中H+数目为0.01NA,A错误;B项,根据电荷守恒可知,B正确;C项,加水稀释促进电离,电离度增大,但氢离子浓度减小,pH增大,C错误;D项,加入NaH2PO4固体,H2PO4-浓度增大,抑制磷酸的电离,溶液的酸性减弱,D错误;
5.(2019•浙江省1月选考)设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法不正确的是( )
A.H2(g)+ O2(g)=H2O(l) ΔH=-286 kJ·mol−1,则每1 mol [H2(g)+ O2(g)]生成1 mol [H2O(l)]放热286 kJ
B.Cr2O72-+ne−+14H =2Cr3 +7H2O,则每生成1 mol Cr3 转移电子数为3NA
C.Al3 +4OH−=[Al(OH)4]−,说明1 mol Al(OH)3电离出H 数为NA
D.1 mol CO2与NaOH溶液完全反应,则n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol
【答案】C
【解析】A项、由热化学方程式可知,氢气在氧气中的燃烧为放热反应,1 mol [H2(g)+ O2(g)]生成1 mol [H2O(l)]放热286 kJ,故A正确;B项、由铬元素化合价变化可知,生成2 mol Cr3 转移6mol电子,则生成1 mol Cr3 转移电子数为3NA,故B正确;C项、氢氧化铝是两性氢氧化物,在溶液中发生酸式电离部分电离出氢离子,则1 mol Al(OH)3电离出H 数小于NA,故C错误;D项、由碳原子个数守恒可知,1 mol CO2与NaOH溶液完全反应生成的盐溶液中,n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol,故D正确;故选C。
6.(2019•浙江省4月选考)设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A. 1 mol CH2=CH2分子中含有的共价键数为6NA
B. 500 mL 0.5 mol·L−1的NaCl溶液中微粒数大于0.5NA
C. 30 g HCHO与CH3COOH混合物中含C原子数为NA
D. 2.3 g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间
【答案】D
【解析】A.1个乙烯分子中碳碳双键含两个共价键,4个碳氢键合为4个共价键,总计6个共价键,因而1mol CH2=CH2分子中含有的共价键数为6NA,A项正确;B.n(Na )=n(Cl-)=0.5L×0.5mol·L-1=0.25mol,n(Na ) n(Cl-)=0.5mol,因而钠离子和氯离子总计0.5NA个,但水会电离出极少量的H 和OH-,因而NaCl溶液中微粒数大于0.5NA,B项正确;C.HCHO与CH3COOH的最简式为CH2O,原混合物相当于30gCH2O,n(CH2O)=1mol,因而C原子数为NA,C项正确;D.不管钠和氧气生成氧化钠还是过氧化钠,钠元素的化合价由0变为 1,因而2.3gNa(2.3gNa为0.1mol)转移电子数为0.1mol×1×NA=0.1NA,D项错误。
核心考点五 物质的量在化学计算中的应用
1.化学方程式中化学计量数与相关物理量的关系c

2.物质的量应用于化学方程式计算的基本步骤

3.以物质的量为中心的各种计量关系