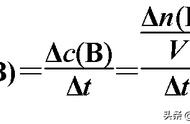②计算中注意以下量的关系。 对反应物:c(起始)-c(转化)=c(某时刻); 对生成物:c(起始)+c(转化)=c(某时刻);

2.化学反应速率的比较方法
(1)定性比较 通过明显的实验现象,如反应的剧烈程度、产生气泡或沉淀的快慢、固体消失或气体充满所 需时间的长短等来定性判断化学反应的快慢。如 K 与水反应比 Na 与水反应剧烈,则反应速 率:K>Na。
(2)定量比较
①“一看”:看化学反应速率的单位是否一致,若不一致,需转化为同一单位。
②“二化”:将不同物质的化学反应速率转化成同一物质的化学反应速率,或分别除以相应 物质的化学计量数,所得数值大的速率大。
③“三比较”:标准统一后比较数值大小,数值越大,反应速率越大
例 1.根据 c~t 图像确定化学方程式及速率 T ℃时,在 0.5 L 的密闭容器中,反应过程中 A、B、C 的浓度变化如图所示

(1)10 s 内 v(B)= 。
(2)该反应的化学方程式为 。
例 2.反应 A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率分别为 ①v(A)=0.15 mol·L -1·min-1 ②v(B)=0.01 mol·L -1·s-1 ③v(C)=0.40 mol·L -1·min-1 ④v(D)=0.45 mol·L -1·min-1 则该反应在不同情况下进行的快慢顺序为
知识点 3 影响化学反应速率的因素
1.内因 在相同条件下,不同的化学反应的反应速率首先是由反应物的组成、结构和性质等因素决定 的
2.实验探究
(1)实验Ⅰ:定性探究影响化学反应速率的外界因素 实验原理

实验方案设计