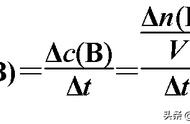由图可知:其他条件不变时,增大压强,气体体积缩小,浓度增大。
②影响规律 对于有气体参加的化学反应,在相同温度下,增大压强(减小容器容积),反应速率增大;减 小压强(增大容器容积),反应速率减小。
(4)其他影响化学反应速率的因素:如光辐照、放射线辐照、超声波、电弧、强磁场、高速 研磨等。总之,向反应体系输入能量,都有可能改变化学反应速率
例 1.相同温度条件下,将下列 4 种不同浓度的 NaHCO3溶液,分别加入到 4 个盛有 20 mL 0.06 mol·L -1盐酸的烧杯中,并加水稀释至 50 mL,NaHCO3 溶液与盐酸反应产生 CO2的速 率由大到小的的顺序是__________________________________________。
①20 mL,0.03 mol·L -1
②20 mL,0.02 mol·L -1
③10 mL,0.04 mol·L -1
④10 mL,0.02 mol·L -1
例 3.某探究小组用 HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素, 所用 HNO3的浓度分别为 1.00 mol·L -1、2.00 mol·L -1,大理石有细颗粒与粗颗粒两种规格, 实验温度为 298 K、308 K
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:

知识点 4 活化能
1.有效碰撞理论
(1)基元反应:大多数的化学反应往往经过多个反应步骤才能实现。其中每一步反应都称为 基元反应。如 2HI===H2+I2的 2 个基元反应为 2HI―→H2+2I·、2I·―→I2。
(2)反应机理:先后进行的基元反应反映了化学反应的反应历程,反应历程又称反应机理。 (3)基元反应发生的先决条件 基元反应发生的先决条件是反应物的分子必须发生碰撞,但是并不是每一次分子碰撞都能发 生化学反应。
(4)有效碰撞

(5)活化能和活化分子
①活化分子:能够发生有效碰撞的分子。 对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是一定的。
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能。
(6)反应物、生成物的能量与活化能的关系图

2.基元反应发生经历的过程