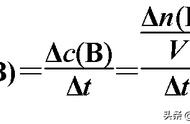3.有效碰撞理论对影响化学反应速率因素的解释
(1)浓度:反应物浓度增大→单位体积内活化分子数增多→单位时间内有效碰撞的次数增加 →反应速率增大;反之,反应速率减小。
(2)压强:增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数增多→单位 时间内有效碰撞的次数增加→反应速率增大;反之,反应速率减小。 即压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
(3)温度:微观解释:升高温度→活化分子的百分数增大→单位时间内有效碰撞的次数增加 →反应速率增大;反之,反应速率减小
(4)催化剂:使用催化剂→改变了反应的历程(如下图),反应的活化能降低→活化分子的百分 数增大→单位时间内有效碰撞的几率增加→反应速率加快。

例 1.已知反应:2NO(g)+Br2(g) 2NOBr(g) ΔH=-a kJ·mol-1(a>0),其反应机理如下 ①NO(g)+Br2(g) NOBr2(g) 快 ②NO(g)+NOBr2(g) 2NOBr(g) 慢 下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小 a kJ·mol-1
D.增大 Br2(g)浓度能增大活化分子百分数,加快反应速率
例 2.设 C+CO2 2CO(吸热反应)的反应速率为 v1,N2+3H2 2NH3(放热反应)的反 应速率为 v2,若对以上两个反应均升高温度,v1、v2会________(填“减小”“增大”或“不 变”),从有效碰撞理论角度分析原因:________。
例 3.在有气体参与的反应中,①增大反应物浓度、②升高温度、③增大压强(压缩体积)、 ④加入催化剂,若以上四种方法均可使反应速率增大,完成下列问题(填序号):
(1)降低反应活化能的是________。
(2)增加活化分子百分比的是________。
(3)未改变活化分子百分比,增加单位体积内分子总数的是________。
(4)增加单位体积内活化分子数的是________。
归纳总结

未完,有需要的朋友私信免费送哦
,