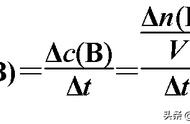(2)实验Ⅱ:反应速率的定量测定和比较 实验步骤
①取一套装置(如图所示),加入 40 mL 1 mol·L -1的硫酸和锌粒,测量收集 10 mL H2所需的时间。

②取另一套装置,加入 40 mL 4 mol·L -1的硫酸和锌粒,测量收集 10 mL H2所需的时间。 实验现象 锌与稀硫酸反应产生气泡(写现象),收集 10 mL 气体,②所用时间比①所用时间 短
实验结果

实验结论 4 mol·L -1硫酸与锌反应比 1 mol·L -1硫酸与锌反应的速率快。
注意事项
①锌的颗粒(即表面积)大小基本相同;
②40 mL 的稀硫酸要迅速加入;
③装置气 密性良好,且计时要迅速准确;
④气体收集可以用排水量气装置(如图所示)代替。

实验讨论 除本实验测定反应速率的方法外,可行的方案还有(至少填两种):
①测定一定时间内产生的 H2的体积;
②测定一段时间内 H +的浓度变化;
③测定一段时间内锌粒的质量变化。
3.外因
(1)在一般情况下,当其他条件相同时,增大反应物浓度,化学反应速率增大;降低反应物 浓度,化学反应速率减小。升高温度,化学反应速率增大;降低温度,化学反应速率减小。 催化剂可以改变化学反应速率。
(2)大量实验证明,温度每升高 10_℃,化学反应速率通常增大为原来的 2~4 倍。这表明温 度对反应速率的影响非常显著。
(3)压强对化学反应速率的影响
①研究对象——气体模型的理解 对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成反比。如图所示: