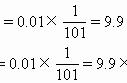A. 阴离子的还原性:Z<W
B. 离子半径:X<Y<Z元
C. 由元素W、X组成的化合物中一定只含极性键
D. s为强酸,r为弱碱
【答案】A

【题型】选择题
【难度】一般
6.金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M nO2 2nH2O=4M(OH)n,已知:电池的"理论比能量"指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多
孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. M﹣空气电池放电过程的正极反应式:正极反应式为O2 2H2O 4e﹣=4OH﹣
D. 比较Mg、Al、Zn三种金属﹣空气电池,Mg﹣空气电池的理论比能量最高
【答案】D
【解析】A.反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,A正确;B.负极上Mg失电子生成Mg2 ,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,B正确;C.正极上氧气得电子和水反应生成OH-,因为是阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2 2H2O 4e﹣=4OH﹣,C正确;D.电池的"理论比能量"指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能
越多,假设质量都是1g时,这三种金属转移电子物质的量分别为1g/24g/mol×2=1/12mol、1g/27g/mol×3=1/9mol、1g/65g/mol×2=1/32.5mol,所以Al-空气电池的理论比能量最高,D错误;答案选D。
【题型】选择题
【难度】一般
7.25℃时,下列关系式正确的是
A. pH=2的CH3COOH 溶液与pH=12的Na0H溶液等体积混合:c(Na )=c(CH3COO-)>c(CH3COOH)
B. 盐酸与FeCl3的混合溶液pH=2,稀释10倍后:pH<3
C. pH相同的① NH4HSO4、② NH4Cl、③(NH4)2SO4三种溶液的c(NH4 ): ③>①>②
D. pH=3的H2C2O4溶液
:c(H )=c(HC2O4-)+c(OH-)=1×10-3mol/L
【答案】B

【题型】选择题
【难度】一般
8.碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业"侯氏制碱法"制取:(原理NaCl H2O CO2 NH3 = NaHCO3↓ NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。