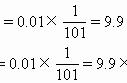类型1 电离常数
概念:在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度的幂乘积与溶液中未电离的分子的浓度之比是一个常数

4.常考题
(1)由电离常数判断酸、碱的强弱、判断某些反应能否发生。
(2)有关计算(计算电离常数、弱酸或弱碱的浓度、pH)。
[对点训练]
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)==[B(OH)4]-(aq)+H+(aq)。下列说法正确的是( )

A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者
D [由电离常数可知酸性:CH3COOH>H2CO3>H3BO3>HCOeq \o\al(-,3)。A项中应生成HCOeq \o\al(-,3);B项中CH3COOH少量,也只生成HCOeq \o\al(-,3);C项中碳酸溶液pH小;D项中CH3COOH比H2CO3易电离,故醋酸溶液pH小。]
已知,25 ℃时几种弱酸的电离常数如表所示:

下列有关推断正确的是( )
A.溶液pH的大小关系为K3PO4>K2HPO4>KH2PO4
B.草酸溶液中存在:c(HC2Oeq \o\al(-,4))>c(H+)>c(C2Oeq \o\al(2-,4))>c(OH-)
C.等浓度的NaHCO3、NaHC2O4溶液中前者pH较大
D.H3C6H5O7与Na2CO3溶液反应的产物为Na3C6H5O7、CO2、H2O
C [A项,未说明溶液的浓度,无法比较,错误;B项,H2C2O4H++HC2Oeq \o\al(-,4),HC2Oeq \o\al(-,4)H++C2Oeq \o\al(2-,4),离子浓度大小关系为c(H+)>c(HC2Oeq \o\al(-,4))>c(C2Oeq \o\al(2-,4))>c(OH-),错误;C项,由电离常数知,H2CO3的酸性比H2C2O4的弱,故NaHCO3的水解程度比NaHC2O4的大,则NaHCO3溶液的pH较大,正确;D项,由电离常数知,酸性H3C6H5O7>H2C6H5Oeq \o\al(-,7)>H2CO3>HC6H5Oeq \o\al(2-,7)>HCOeq \o\al(-,3),故H3C6H5O7与Na2CO3溶液反应的产物中没有Na3C6H5O7,错误。]
3.(1)常温下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________(用含a和b的代数式表示)。
(2)25 ℃时,H2SO3==HSOeq \o\al(-,3)+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下pH=3、c(HSOeq \o\al(-,3))=0.1 mol·L-1的NaHSO3溶液中c(H2SO3)=________。
[解析] (1)2c(Ba2+)=c(CH3COO-)可知c(H+)=c(OH-),c(CH3COO-)=2×b×eq \f(1,2) mol·L-1,