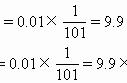今天S老师与大家分享如何利用“3步走”解决分压平衡常数的计算问题,助力同学们在高考中顺利拿分!
首先我们来看这样一道例题,这道题来自于2019年高考全国二卷的第27题,题目首先给出了如图的3号反应方程式,并且给出信息,某温度下,等物质的量的碘和环戊烯在刚性容器内发生该反应,起始总压为10^5 Pa,平衡时总压增加了20%,最后要求同学们计算该反应的分压平衡常数Kp=_______Pa。

例题来源:2019年高考全国卷第27题第(2)问
分压平衡常数的计算,由于它牵涉到了平衡时总压强和各组分分压的计算,所以相比于直接用各组分浓度来计算化学平衡常数要更复杂一些,也是近几年高考题中的常考问题。
为了应对这样一个问题,S老师教大家分3步来进行计算。
第1步:找总压首先第一步,一定是找到平衡后体系的总压强,因为只有有了总压,我们才能进一步计算各组分的分压。当然这个题,由于文字信息已经很清楚的告诉了我们相关信息,所以我们可以很快就求得平衡时体系总压为 1.2×10^5 pa。
第2步:算分压接下来第二步呢,是“算分压”。
我们需要计算平衡时各气体组分的分压。这里所谓的平衡时的分压 = 总压 × 每一种气体的物质的量分数,所以求解平衡时的分压的关键,就是求解平衡时各气体的物质的量分数。为此呢,我们列出计算平衡问题时常用的“三段式”,并且根据题目信息,假设起始时加入的环戊烯和碘单质的物质的量分别为 1 mol,可知平衡时气体总物质的量就为 (2 x) mol,那么这里的 x 的求解,还得再次利用题目信息,由于平衡时刚性容器中气体总压增加了 20%,也就意味着“平衡时气体总物质的量”为“初始气体总物质的量”的 1.2 倍,所以这里的 2 x 就等于 2.4 mol,所以 x 等于 0.4 mol,到此为止,我们就知道了平衡时各气体的物质的量,进而也就可以求出平衡时各气体的物质的量分数。

第2步:算分压,求解过程
有了这样一个各气体的物质的量分数呢,我们就可求出各气体的分压。
比如平衡时,环戊烯的物质的量分数为 25%,那么平衡时环戊烯的分压就是四分之一乘以总压,等于 0.3 ×10^5 pa。同理可以求出其他三种气体的分压。

轻松求得最终结果
最后,第3步,列算式,写出Kp的计算公式,将前几步所得数据代入,就可以求出最终的结果。
以上就是S老师今天想和同学们分享的《3步走解决分压平衡常数的计算问题》的解题过程,同学们,你学会了吗?希望大家能够在遇到类似问题时能够迁移应用,也祝愿同学们在考试中遇到此类问题时能够顺利拿分!
,