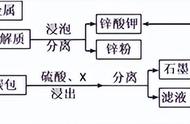
Ksp本质是简单的物理性质,决定了物质是否能够溶解,又进一步决定了化学反应中的沉淀生成。
溶质溶解的过程是一个可逆过程:
固体溶质溶解结晶溶液中的溶质
以AgCl(s)==Ag+(aq)+Cl-(aq) ΔH>0为例,填写外因对溶解平衡的影响
外界条件 | 移动方向 | 平衡后c(Ag+) | 平衡后c(Cl-) | Ksp |
升高温度 | 正向 | 增大 | 增大 | 增大 |
加水稀释 | 正向 | 不变 | 不变 | 不变 |
加入少量AgNO3 | 逆向 | 增大 | 减小 | 不变 |
通入HCl | 逆向 | 减小 | 增大 | 不变 |
通入H2S | 正向 | 减小 | 增大 | 不变 |
与QC比较就揭示了沉淀的生成。
以AmBn(s)==mAn+(aq)+nBm-(aq)为例:
溶度积 | 离子积 | |
概念 | 沉淀溶解的平衡常数 | 溶液中有关离子浓度幂的乘积 |
符号 | Ksp | Qc |
表达式 | Ksp(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是平衡浓度 | Qc(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是任意浓度 |
应用 | 判断在一定条件下沉淀能否生成或溶解 ①Qc>Ksp:溶液过饱和,有沉淀析出 ②Qc=Ksp:溶液饱和,处于平衡状态 ③Qc<Ksp:溶液未饱和,无沉淀析出 | |