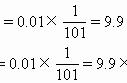类型4 水解平衡常数

3.影响因素:温度(升温,Kh增大)。
4.Kh与Kw、Ka、Kb、Ksp之间的关系
(1)一元弱酸一元强碱盐:Kh=Kw/Ka;
(2)一元强酸一元弱碱盐:Kh=Kw/Kb;
(3)一元弱酸一元弱碱盐,如醋酸铵:Kh=Kw/(Ka×Kb);
(4)多元弱碱一元强酸盐,如氯化铁:
Fe3+(aq)+3H2O(l)==Fe(OH)3(s)+3H+(aq)
水是纯液体,Fe(OH)3是固体物质不列入平衡常数。
Kh=c3(H+)/c(Fe3+)。
将Keq \o\al(3,w)=c3(H+)×c3(OH-)与Ksp=c(Fe3+)×c3(OH-)两式相比消去c3(OH-),所以,Kh=Keq \o\al(3,w)/Ksp。
5.常考题型
(1)考查盐溶液的性质(酸、碱性等)。
(2)考查对应弱酸的相对强弱。
(3)有关计算(计算Kh、浓度、pH等)。
[对点训练]
10.已知:25 ℃时醋酸的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,水的离子积常数:Kw=c(H+)·c(OH-)=1×10-14。则25 ℃时,0.1 mol·L-1 CH3COONa水溶液中,c(OH-)约为(已知:eq \r(1.8)≈1.34)( )
A.1×10-7 mol/L B.1.8×10-6 mol/L
C.7.5×10-6 mol/L D.7.5×10-5 mol/L
C [本题设计的意图是利用数学关系巧妙代换求出水解平衡常数,灵活地考查了水解平衡常数与电离平衡常数、水的离子积常数之间的关系。分析如下:

11.25 ℃时,H2SO3==HSOeq \o\al(-,3)+H+的电离常数Ka=1×10-2,则该温度下NaHSO3水解反应的平衡常数Kh=________,若向NaHSO3溶液中加入少量的I2,则溶液中

将________(填"增大""减小"或"不变")。