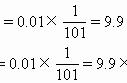(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2) I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________⑶第二步中让_____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):

⑸请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
【答案】 ⑴ d c
⑵ 长颈漏斗 饱和碳酸氢钠溶液
⑶Ⅱ
⑷ NaCl 取少量固体放入试管中,加热,固体大部分消失,在试管口内壁又有较多的固体凝结。
⑸ CO2在水中存在平衡:CO2 H2O

H2CO3

HCO