MgN 8 HO=3Mg(OH)↓ 2NH↑。
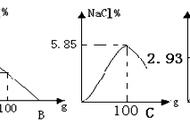
从海水中来提取MgCl时的流程:加氢氧化钙,过虑洗涤得氢氧化镁沉淀,用盐酸溶解沉淀,通过蒸发浓缩、冷却结晶得到MgCl·6HO晶体,再在HCl气体环境中加热MgCl·6HO晶体得到无水MgCl,HCl气流主要是为了抑制Mg水解;电解熔融的MgCl,不用MgO电解来制备Mg是因为MgO熔点很高,需要能量高。
14.铝及其化合物
铝是地壳中含量最多的金属元素,工业上不用电解AlCl来制备铝的原因是AlCl是分子晶体在熔融的状态下不导电(必修二P93第6题从铝土矿中提取铝的有关反应)。
P58
氧化铝的性质用途:氧化铝为两性氧化物,是电解质。
P58
实验3-7、实验3-8
氢氧化铝是两性氢氧化物,为弱电解质。实验室制备Al(OH)的离子方程式为:Al 3NH·HO == Al(OH)↓ 3NH,不用NaOH等强碱原因是Al(OH) OH == AlO 2HO,以下几种方法也可以得到氢氧化铝。
取0.25ag铝(铝的质量为a g)溶于适量的盐酸中,再取0.75a g铝溶于适量的强碱溶液中,将两溶液混合即得白色沉淀,3AlO Al 6HO == 4Al(OH)↓;
偏铝酸钠溶液中通CO。CO少量与过量时也可以得到氢氧化铝。(CO少量)CO 3HO 2NaAlO == 2Al(OH)↓ NaCO、(CO过量)CO 2HO NaAlO == Al(OH)↓ NaHCO。
Al和AlO的转化:Al 4OH == AlO 2HO、AlO 4H == Al 2HO
AlO和HCO不能共存。不是双水解,是得质子的能力不同引起的:
AlO HCO HO= Al(OH)↓ CO
明矾的净水:明矾、FeCl·6HO被称作净水剂,原因是Al、Fe水解形成胶体(Al 3HOAl(OH) (胶体) 3H),吸附水中的悬浮物,使之沉降已达净水目的,只有净水作用,无*菌、消毒作用。
向明矾溶液是加入Ba(OH)溶液,沉淀的质量最大和沉淀的物质的量最大的离子方程式分别为:Al 2SO 2Ba 4OH=AlO 2BaSO↓ 2HO 、2Al 3SO 3Ba 6OH= 2Al(OH)↓ 3BaSO↓
泡沫灭火器Al(SO)溶液不能装在铁桶中是因为Al水解显酸性,NaHCO溶液不能装在玻璃桶中是因为HCO水解呈碱性。泡沫灭火器反应原理:Al 3 HCO == Al(OH)↓ CO↑。
15.铁及其化合物
P59
铁中含有碳等杂质,使铁的熔点降低,在常温下浓硫酸和浓硝酸使铁钝化。铁的氧化物中,赤铁矿(FeO)红棕色粉末,俗称铁红,常用着红色油漆和涂料。也是炼铁的原料。磁铁矿(FeO)具有磁性,俗称磁性氧化铁,是黑色晶体。FeO是一种黑色粉末,在空气里加热就迅速氧化成FeO.铁在Cl中燃烧无论Fe或Cl过量均生成FeCl,但可以用化合反应生成FeCl,相关反应为:2Fe 3Cl 2FeCl,Fe 2 FeCl == 3FeCl。铁的氧化物与非氧化性酸,强氧化性酸,还原性酸反应的特殊性。FeO 8H= 2Fe Fe 4HO,FeO 6H 2I=2Fe I 3HO,3FeO 10H NO=3Fe NO↑ 5HO。Fe被氧化,Fe被I还原。
P60
铁的氢氧化物:在制备Fe(OH)时可以加热到沸腾除水中的氧,冷却后再配溶液,也可以加比水轻,不溶于水的有机溶剂(苯)封住液面,加NaOH溶液时胶头滴管要伸入到溶液中接近试管底,防止Fe被氧化,可以加入铁粉,Fe(OH)氧化成Fe(OH)的现象为白色絮状沉淀迅速变成灰绿色,最后红褐色,化学方程式4Fe(OH) O 2HO == 4Fe(OH)。加热FeCl溶液,最终得到的是FeO。氧氧化铁、氢氧化亚铁分别与强氧化性酸,还原性酸反应的:(OH) 6H 2I=2Fe I 6HO,
3Fe(OH) 10H NO=3Fe NO↑ 8HO。
Fe、Fe的性质及其检验。检验Fe通常有以下几种方法:
①加KSCN溶液,无明显变化,再加氯水,溶液变血红色。Fe 3SCN≒Fe(SCN)。
②加氢氧化钠溶液,出现白色絮状沉淀迅速变成灰绿色,最后红褐色。4Fe(OH) O 2HO == 4Fe(OH)。
③加溶KFe(CN)溶液,生成蓝色沉淀。3Fe 2[ Fe(CN)]=Fe[ Fe(CN)]↓
检验Fe通常有以下几种方法:
接观察溶液是棕黄色。滴加氢氧化钠溶液,出现红褐色沉淀;滴加KSCN溶液,有血红色溶液出现;加入苯酚溶液,呈紫色。
P62
图3-21铜绿的主要成分为Cu(OH)CO。
P62
第10题,FeCl溶液作为刻制印刷电路时的“腐蚀液”,其离子方程式为:
Cu 2 Fe== 2Fe Cu.
P64
倒数第二段:合金的硬度大于它的纯金属成分,合金的熔点低于它的成分金属。青铜是我国使用最早的合金。
P65
钢是用量最大、用途最广的合金。根据其化学成分,可以分为碳素钢和合金钢。
P70 第6题。选C。
16.硅及其化合物
P74
碳是构成有机物的主要元素,而硅是构成岩石与许多矿物的基本元素。硅是一种亲氧元素,在自然界中它总是与氧相互化合的,在自然界中主要以熔点很高的氧化物SiO及硅酸盐的形式存在。结晶的SiO是石英,其中无色透明的是水晶,具有彩色环带或层状的称为玛瑙。沙子中含有小粒的石英晶体。纯净的SiO是现代光学及光纤制品的基本原料。可以用HF刻蚀玻璃,是因为SiO可与HF酸反应(SiO 4HF=SiF↑ 2HO),但SiO不是两性氧化物。SiO为酸性氧化物,但不溶于水生成硅酸。盛碱溶液的试剂瓶一般用橡胶塞(P76图4-6)因为SiO易与强碱溶液反应,生成硅酸钠使试剂瓶受腐蚀。SiO为原子晶体,不存在单个的SiO分子,1mol的SiO中含有4mol的Si-O键。
P76
HSiO是一种酸性比HCO还弱的弱酸。“硅胶”吸附能力强,常用作实验室和袋装食品、瓶装药品的干燥剂。HSiO可以由可溶性的硅酸盐与相对较强的酸用作生成HSiO。在NaSiO溶液中分别加入盐酸和通入CO,其化学方程式分别为NaSiO 2HCl=2NaCl HSiO↓、NaSiO HO CO=NaCO
HSiO↓。若CO过量,则反应为:NaSiO 2HO 2CO=2NaHCO HSiO↓
P77
硅酸钠(NaSiO) 的水溶液俗称水玻璃,不能燃烧,不易被腐蚀,热稳定性强,是制备硅胶和木材防火剂的原料。NaSiO写成氧物的形式可以表示为NaO·SiO。
P77
资料卡片硅酸盐组成写成的方法。
P78
通玻璃是以纯碱、石灰石和石英为原料,在玻璃窑中熔化制得的。水泥是以黏土和石灰石为主要原料,在水泥回转窑中煅烧,再加入适量的石膏研成细粉。普通玻璃和水泥的共同原料是石灰石。
P78
碳化硅(俗称金刚砂),属于原子晶体。碳化硅、硅刚、硅橡胶、人工制造的分子筛等的性质和用途。
P79
科学视野:新型陶瓷
P79
晶体硅属于原子晶体,金刚石,晶体硅,碳化硅熔点由低到高的顺序为晶体硅<碳化硅<金刚石。导电性介于导体和绝缘体之间,是良好的半导体材料。在常温下可与氟气、氢氟酸(Si 4HF=SiF↑ 2H↑)和强碱发生反应(Si 2OH HO=SiO 2H↑)。
P80
硅的应用:图4-12、图4-13、硅是人类将太阳能转化为电能的常用材料。
P81
习题5:仪器坩埚的种类及使用注意事项
P81
第9题硅的制备及提纯:粗硅的制取生成的CO,由硅的氧化物制取硅主要的三个化学反应。理解“从沙滩到用户”。
17.氯及其化合物
P82
氯元素是重要的“成盐元素”。主要以NaCl的形式存在于海水和陆地的盐矿中,海水不能直接饮用。
P82
科学视野-氯气的发现和确认及思考与交流。
P83
Cl是一种黄绿色有强烈剌激性气味的有毒气体。闻Cl的正确操作方法(图4-15)。铁在氯气中燃烧产生棕色的烟(2Fe 3Cl


P84
很多自来水厂用氯气*菌、消毒。是由于氯气溶于水生成的HClO有强氧化性。HClO是一元弱酸,其酸性比HCO弱,HClO不稳定,在光照条件下分解为盐酸和O、氯水保存在棕色试剂瓶中。干燥的氯气无漂白作用。氯气溶于水的化学方程式为HO Cl≒HCl HClO,标况下,2.24L氯气溶于水,转移电子数小于0.1N,酸性条件下,Cl和ClO不能共存,将Cl通入紫色石蕊溶液现象是先变红,后褪色。氯水有关还原剂反应的方程式,除漂白作用,化学方程式都以Cl作为反应物。如淀粉-KI试纸遇氯水变蓝(2I Cl=2Cl I),氯水滴加到NaS溶液中有淡黄色沉淀(S Cl=2Cl S↓)。Cl溶于水有漂白作用,SO也有漂白作用,将Cl和SO等体积混合溶于水,漂白作用消失,原因是:Cl SO 2HO=4H 2Cl SO
P85
工业上制漂白粉的反应为:2Cl 2Ca(OH)=CaCl Ca(ClO) 2HO,漂白粉有主要成份是CaCl和Ca(ClO),有效成份是Ca(ClO),漂白粉空气中失效相关的化学方程式为Ca(ClO)+CO+HO=CaCO+2HClO,2HClO=2HCl O↑。漂白液是以NaClO为有效成分的溶液,又叫“8.4”消毒液,因水解而略呈碱性,它不能和洁厕精共用,原因是NaClO+2HCl=NaCl Cl↑+HO。漂白液、漂白粉和漂粉精可用漂白棉、麻、纸张的漂白剂,又可以用作游泳池及环境的消毒剂。

P85-86 Cl的检验
P88
第14题:主要涉及Cl的实验室制法。如右图:
烧瓶中发生的化学反应方程式为:
MnO 4HCl(浓)