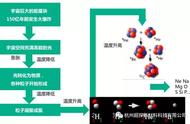
(1)P点的含义是______。
(2)t2℃时,50g H2O与50g X混合,所得溶液中溶质质量分数为______。
(3)将t1℃时X、Y和Z三种物质的饱和溶液分别升温至t2℃,有晶体析出的是______。
(4)欲使Y的饱和溶液变为不饱和溶液,可以采取的措施是______(任写一种)。
【答案】(1)在t1℃时,X和Z的溶解度相等
(2)20% (3)Z
(4)加水##升高温度
【解析】
【小问1详解】
P点的含义是:在t1℃时,X和Z的溶解度相等;故答案为:在t1℃时,X和Z的溶解度相等;
【小问2详解】
t2℃时,X的溶解度是25g ,50g H2O与50g X混合后完全溶解剩余37.5g的X未溶解,所得溶液中溶质质量分数为
,故填:20%;
【小问3详解】
将t1℃时X、Y和Z三种物质的饱和溶液分别升温至t2℃,有晶体析出的是Z,因为X、Y两种固体物质的溶解度,都是随温度升高而增大,而Z的溶解度随温度的升高而减少;故答案为:Z;
【小问4详解】
Y的溶解度随温度的升高而增大,欲使Y 的饱和溶液变为不饱和溶液,可以采取的措施是:加水、升高温度等;故答案为:加水或升高温度。
18. 阅读下面科普短文,回答有关问题。
甲醛(CH2O)在常温下是无色、有刺激性气味的气体,极易溶于水,是重要的工业原料。由于甲醛具有较高毒性,影响人体健康,因此刚装修好的房屋不宜立即入住,需开窗通风一段时间。
某实验小组在4个密闭仓中分别研究了绿萝、白鹤芋、吊兰、袖珍椰子4种观叶植物0-12h内净化甲醛的能力(图1)和绿萝在0-4h、4-8h、8-12h不同时间段净化甲醛的趋势(图2)。从图2中可以看出不同时间段植物净化甲醛的速率不同,造成这种现象的原因可能有两点,一是甲醛初始浓度高,对植物形成胁迫作用,植物为了缓解这种胁迫而调动自身某些快速反应机制将甲醛吸收代谢,当密闭仓中甲醛浓度降低到一定值时,植物感到胁迫降低,就放慢了代谢速率;二是植物的根系及盆土起到一定的净化作用,在较短时间内降低密闭仓中的甲醛浓度。(原文作者:宋岚)


(1)活性炭对甲醛也有一定净化能力,是因为活性炭具有_________性。
(2)由图1可知,4种观叶植物净化甲醛百分率由大到小的顺序是_________。
(3)根据图2分析,绿萝在_________时间段内净化甲醛的速率最高。
(4)下列说法正确的是_________。
A 用大量甲醛给海产品保鲜
B 甲醛是重要的工业原料,但使用时需考虑其对环境的影响
C 在甲醛浓度较高的初始阶段,根系和盆土没有起到净化作用
D 通风换气不能降低室内甲醛含量
【答案】 ①. 吸附 ②. 白鹤芋>绿萝>吊兰>袖珍椰子 ③. 0-4h ④. B
【解析】
【详解】(1)活性炭具有吸附性,对甲醛也有一定的净化能力。
(2)根据题中信息可知,4种植物净化甲醛百分率的大小关系是白鹤芋>绿萝>吊兰>袖珍椰子。
(3)绿萝在0-4h时间段内净化甲醛的速率最高。
(4)A、甲醛有毒,不能用大量甲醛给海产品保鲜,不符合题意;
B、甲醛是重要的工业原料,但甲醛有毒,使用时需考虑其对环境的影响,符合题意;
C、在甲醛浓度较高的初始阶段,根系和盆土起到了净化作用,不符合题意;
D、通风换气,能降低室内甲醛含量,不符合题意。
故选B。
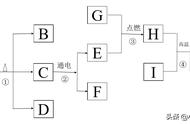
19. 工业上生产电路板及处理废液的工艺流程如图:

已知:Fe 2FeCl3═3FeCl2
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是______。
(2)步骤②中发生置换反应的化学方程式为______,说明金属的活动性:铁______铜。
(3)步骤③加入稀盐酸充分搅拌,当观察到______的现象时,说明滤渣只剩铜。
【答案】(1)氯化亚铁、氯化铜(或FeCl2、CuCl2)
(2) ①. Fe CuCl2=FeCl2 Cu ②. >
(3)不再有气泡产生
【解析】
【分析】镀铜电路板要得到氯化亚铁和铜两种产物,铜元素铜镀铜电路板转化为氯化铜,最终变为金属铜;铁元素存在形式从氯化铁转变到氯化亚铁。
【小问1详解】
通过流程图中步骤①后废液中有氯化铁、氯化亚铁和氯化铜,其中氯化亚铁和氯化铜是新产生的,故填:氯化亚铁、氯化铜(或FeCl2、CuCl2);
【小问2详解】
步骤②中铁和氯化铜能发生置换反应,说明铁的金属活动性比铜强,故填:
;>;
【小问3详解】
步骤③中滤渣中有铜和铁,铁和稀盐酸反应有气泡产生,加入稀盐酸充分搅拌,当观察到没有气泡产生时,说明滤渣只剩铜,故填:不再有气泡产生。
【点睛】分析过程重要特别注意铜元素和铁元素的反应和转化。
三、实验题:本大题2小题,共13分。
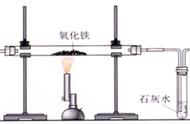
20. 请结合图示实验装置,回答下列问题。