相对原子质量:C—12 O—16 Ca—40
1、 选择题(本题共15小题,每小题1分,共15分。每题只有一个选项符合题意)
1.下列变化中,属于化学变化的是( ) A.石蜡熔化 B.纸张燃烧 C.酒精挥发 D.胆矾研碎
2.空气中含量较少,且化学性质很不活泼的是( )
A.氮气 B.氧气 C.稀有气体 D.水蒸气
3.下列物质中,属于纯净物的是( ) A.液态氢 B.洁净的空气 C.汽水
D.水泥砂浆
4.下列物质中,属于单质的是( )
A.红磷 B.氧化汞 C.硫酸铜 D.氢氧化钾
5.下列物质中,属于氧化物的是( ) A.O2 B.C6H12O6 C.MgO D.HCl
6.下列化学符号中,只有微观意义的是( )
A.H B.H2 C.2H D.Cu
7.下列说法中,不正确的是( )
A.碳元素组成的单质由于原子排列方式不同,性质存在明显差异
B.金刚石是天然存在的最硬的物质
C.石墨可用于制铅笔芯、电刷或电极
D.C60是一种新型化合物,具有优良的导电性
8.与元素的化学性质关系最密切的是( )A.原子的最外层电子数 B.原子的核外电子数
C.元素的核电荷数 D.元素的相对原子质量
9.下列叙述中,正确的是( )
A.地球上的水资源丰富,水体污染不会对人类用水产生影响
B.低碳理念就是减少有毒的空气污染物二氧化碳的排放
C.煤炉上放一壶水就能防止一氧化碳中毒
D.可燃性的气体或粉尘,在空气中遇到明火,都有发生爆炸的危险
10.认识燃烧原理可以利用和控制燃料。下列说法中,正确的是( )
A.物质与氧气反应时都会发生燃烧
B.只要达到燃烧所需的最低温度,可燃物就能燃烧
C.把木柴架空,可使木柴更充分接触空气而燃烧得更旺
D.用嘴吹蜡烛,蜡烛熄灭是因为降低了蜡烛的着火点
11.硝酸(HNO3)中氮元素的化合价是( )
A. 2 B. 3 C. 4 D. 5
12.下列关于微粒的说法,正确的是( ) A.物质受热膨胀,是物质分子的大小和间隔受热时增大的缘故
B.香水、汽油要密闭保存,是因为分子不断运动的缘故
C.原子是最小的粒子,不可再分
D.二氧化碳是由碳原子和氧分子保持其化学性质
13.氢氧化钙溶液与碳酸钠溶液反应方程式为:Ca(OH)2 Na2CO3=CaCO3↓ 2X。则X的化学式是( )
A.Na2O B.NaOH C.Na2O2 D.NaHCO3
14.下列微粒结构示意图中,表示阳离子的是( )

15.下列关于金属材料的叙述,正确的是( )
A.常温下,金属都是固体
B.地壳中含量最高的金属元素是铁
C.导线用铜不用银,因为铜的导电性比银的好
D.日常生活中大量使用的常常不是纯金属,而是它们的合金
二、填空题(本题共5小题,每空1分,共25分)
16.用化学用语(化学符号)表示下列物质或微粒。
(1)①干冰 ;②硫酸根离子
(2)①甲烷 ;②乙醇(酒精)
(3)氯化钠是由 构成。
17.水是一切生命体所必需的物质。
(1)净水器中的活性炭可以 、 水中的杂质,从而除去水中的不溶性物质和异味。
(2)检验软水和硬水可用 ,生活中通过 可以降低水的硬度。
18.化石燃料造福人类,同时也带来一些问题。
(1)目前,人们使用的化石燃料主要是煤、石油、 ,它们是不可再生能源。将石油加热炼制,得到的产品之一是 。
(2)煤燃烧时排放出 ,溶于雨水会形成酸雨;减少酸雨的措施之一是 。
(3)氢能源目前无法大量使用的原因是 。
19.金属资源广泛用于工农业生产等领域。
(1)工业上,利用一氧化碳和氧化铁反应来炼铁,写出该反应的化学方程式:
(2)铁制品锈蚀的过程,实际上是铁与空气中的 发生化学反应的过程;防止厨房中的铁锅锈蚀的方法是 。而铝在空气中具有很好的抗腐蚀性能,原因是 。
(3)回收利用废旧金属的意义是
。(只答一点即可)
20.写出下列反应的化学方程式,并注明反应的基本类型。
(1)铁丝在氧气中剧烈燃烧,火星四射 ① ②
(2)加热氯酸钾和二氧化锰的混合物制氧气① ②
(3)实验室常用锌粒和稀硫酸制取氢气 ① ②
三、简答题(本题共5小题,共24分)
21.(3分)用两团棉花球分别蘸酒精和水,放在酒精灯火焰上加热片刻。观察到酒精燃烧,而水没有燃烧。
(1)通过此实验,可以说明燃烧的条件之一是什么?
(2)重新进行上述实验,加热时间变长。发现两团棉花球都会燃烧起来,分析原因
22.(4分)用学过的知识解释下列问题:
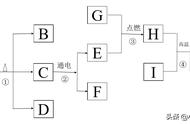
(1)从微观角度分析水通电分解的过程。
(2)水在通电的条件下生成氧气,过氧化氢在二氧化锰的催化作用下也生成氧气。当分子个数相等的过氧化氢和水完全分解,生成氧气的量相等,为什么?
23.(6分)下图是实验室制取气体常用的装置。请回答下列问题:

(1)实验室用装置A加热高锰酸钾制氧气,化学方程式为① 。
(3)收集二氧化碳应选择装置① ,原因是② 。
24.(6分)木炭与氧化铜在高温下反应,生成铜和二氧化碳。反应进行一段时间后,停止加热。待固体冷却后,取出。为了将固体中的铜元素以纯净的铜单质的形式回收,某实验小组将固体分为两份,分别设计了如下两个方案:
方案一:
1、在空气中充分灼烧固体,至没有火星产生。
2、将灼烧后的固体放在玻璃管中,通入足量的一氧化碳,加热至固体全部变为红色,冷却后取出。
方案二:
1、在空气中充分灼烧固体,至没有火星产生。
2、将灼烧后的固体,加入稍过量的稀硫酸中,充分反应,至黑色固体完全消失。
3、向反应后的溶液中加入稍过量的铁粉,充分反应,至红色固体不再增加,黑色固体剩余。
4、……
5、过滤出固体,洗涤、烘干,得到铜单质;剩余液体为硫酸亚铁溶液。
【资料】某些金属氧化物能与酸反应,如:CuO H2SO4 = CuSO4 H2O
(1) 两个方案中第1步的作用是 。
(2)方案一有可能对环境造成污染,请写出处理方法: 。
(3)写出方案二第3步所发生反应的化学方程式 。
(4)将方案二
四、计算题(本题共1小题,共6分)
25.煅烧石灰石(主要成分CaCO3),可制得氧化钙(CaO)和二氧化碳。
(1)如果完全分解10g碳酸钙,可生成氧化钙的质量是多少?
,