澳大利亚病毒学家麦克法兰·伯内特(右三)和梅达沃共同获得了1960年的诺贝尔生理学或医学奖
日常生活中,钥匙的作用是开锁,但抗体钥匙的作用却是将抗原锁锁住,使之不再发挥作用,科学术语称之为“中和”(Neutralize)。于是有人想到,可以将病原体的某个重要的表面抗原制成疫苗,诱导免疫系统生产出专门针对它的抗体,将病原体“中和”掉。这个疫苗研发思路是革命性的,因为某些传染病用老思路解决不了,比如乙型肝炎就是如此。乙肝病毒的体外培养非常困难,无论是减活疫苗还是灭活疫苗都很难生产出来。1963年,有人意外地在血友病人的血清中发现了乙肝表面抗原(HBsAg,曾经被命名为澳抗),默克制药公司的莫里斯·希尔曼(Maurice Hilleman)博士尝试以它为原材料制造乙肝疫苗,并于1981年获得了成功。
这是人类发明的第一种针对单一抗原的预防性疫苗,具有划时代的意义。此前的疫苗都是用整个病原体做原材料,其中包含的抗原种类非常多,诱导出的抗体种类自然也非常多,很容易和人体内的其他结构相似的蛋白质发生交叉反应,这就是疫苗副作用的一大来源。比如上世纪40年代研制成功的第一代百日咳疫苗用的是灭活的百日咳杆菌,但因为细菌表面有上千种不同的抗原,诱导出的免疫反应太过复杂,经常会让接种者发高烧,打针处红肿不退,不少家长因为不喜欢这些副作用而拒绝给自己的孩子接种,导致70年代百日咳疫情卷土重来。后来科学家们研制成功了专门针对某一种百日咳杆菌表面抗原的疫苗,有效性和第一代疫苗相差不大,但副作用大为减少,家长们这才打消了顾虑。

印度尼西亚巴厘岛的医护人员在当地一所学校为学生进行传染病检测
希尔曼博士发明的乙肝疫苗虽然效果不错,但有个严重的问题,那就是他只能从乙肝病人的血清中收集乙肝表面抗原作为疫苗的原材料,成本很高不说,还极有可能带来污染。事实上,当年乙肝和艾滋病这两个患者群体有很多重合,不少人怀疑希尔曼博士的乙肝疫苗才是导致艾滋病在美国大暴发的真凶。虽然后续研究证明他当年采用的病毒灭活方法非常可靠,没有造成交叉感染,但这件事还是吓住了不少人,严重影响了乙肝疫苗的接种率。
这个问题最终还是依靠科技进步解决的。70年代诞生的基因工程技术使得科学家们可以把编码蛋白质的基因整合进酵母菌的基因组中,诱导后者生产出大量特定的外源蛋白质。1986年,基于这项技术的基因工程*乙肝疫苗问世,人类终于有了廉价又安全的乙肝疫苗。这件事还标志着疫苗研发正式进入了设计时代,科学家们可以根据病原体的生物学特征,设计出专门针对某个表面抗原靶点的单克隆抗体疫苗,这就大大减少了疫苗的副作用。
早期的基因*疫苗属于蛋白质疫苗,生产者需要事先将特定基因导入酵母菌的基因组,并在发酵罐里培养酵母菌,然后再从培养液中将目标蛋白质提取出来,才能制成疫苗。整个过程不但耗时长,而且成本也居高不下。后来有人想到,为什么不想办法省掉酵母菌这一步,直接把编码蛋白质的遗传物质(核酸)导入人体,让人体细胞自己去生产抗原蛋白呢?于是,核酸疫苗诞生了。
核酸疫苗最大的技术难点就是如何将外源核酸(DNA或者RNA)安全地导入人体细胞,并让其发挥应有的作用。为了实现这一目标,科学家们想出了各种办法。有人尝试用纳米颗粒包裹遗传物质,再将其送入细胞内。还有人尝试将某种病毒的基因组稍加改造,去掉其中的致病基因,制成一种病毒载体。此后只要将目标基因装入这个病毒载体,就可以利用病毒感染人体细胞的特殊能力,将外援基因导入人体细胞了。
“新冠疫苗六杰”之一的研发者美国莫德纳(Moderna)公司是前一项技术的全球领军者,尤其擅长制造基于mRNA技术的核酸疫苗。他们研制的代号为mRNA-1273的新冠疫苗早在2020年3月16日就在美国西雅图市进行了第一例人体试验,距离第一个新冠确诊病例的出现仅仅过去了67天,创下了人类疫苗研发史上的最快纪录。如此快的速度有两个原因:一个是中国科学家在确定病原体4天之后就向全世界公布了新冠病毒基因组全序列,这个速度是史无前例的;另一个原因是美国国家过敏与传染病研究所(NIAID)的疫苗专家巴尼·格拉姆(Barney Graham)博士在拿到病毒序列后,只花了3天时间就计算出了疫苗的最佳靶点,这个速度同样也是史无前例的。
全球第二例新冠疫苗人体试验是中国军事科学院军事医学研究院陈薇院士领衔的研究团队和天津康希诺生物股份公司联合开发的Ad5-nCoV载体疫苗,用的是一种经过改造的人类腺病毒(ADEnovirus)基因载体。牛津大学和阿斯利康(AstraZeneca)合作研发的ChAdOx1疫苗也是一种载体疫苗,用的是一种源自黑猩猩腺病毒的基因载体。载体疫苗最大的特点就是性能稳定,有效期长,而且已有成功案例(埃博拉疫苗就是载体疫苗)。而德国BioNTech公司研发的新冠疫苗BNT162b2则与莫德纳的mRNA-1273类似,都属于mRNA型核酸疫苗。这种疫苗的特点是起效快,免疫原性强,生产过程简单,但这一技术路线在新冠疫苗以前尚无成功案例。

中国工程院院士陈薇在实验室工作(新华社 供图)
以上这4种疫苗都属于核酸疫苗,针对的靶点都是位于新冠病毒表面的刺突蛋白(Spike Protein),不同的只是有的人用脱氧核糖核酸(DNA),有的人用信使核糖核酸(mRNA)而已。虽然核酸种类不同,但两者本质上都是把生产蛋白质的图纸送入人体细胞,指导后者源源不断地生产出相应的抗原蛋白,因此核酸疫苗的免疫活性大致介于减活疫苗和灭活疫苗之间,我们可以简单地将其看成是一种介于活病毒和死病毒之间的减活疫苗。
这几款核酸疫苗之所以能够在如此短的时间里就被研制出来,一方面要感谢病毒学和基因工程这两个基础科学领域的飞速进步,另一方面则要感谢“非典”期间科学家们对SARS病毒所做的基础研究。因为SARS病毒和新冠病毒同属冠状病毒家族,两者入侵细胞的方式非常相似,所以新冠疫苗的最佳靶点很快就找到了,节省了很多时间。相比之下,当年“非典”疫情暴发后,疫苗研发者们用了323天才开始做第一例人体试验,比新冠晚了8个多月。换句话说,假如这次疫情不是源自冠状病毒,而是源自某个人类以前从未见过的新型病毒,我们很可能需要多等一年的时间才能有疫苗。从这点来看,人类已经算是很幸运的了。
除了研发速度快之外,核酸疫苗还有个很重要的好处,那就是生产工艺相对简单,生产成本较低。一旦被批准,很容易迅速扩大产能,生产出足够多的廉价疫苗供全世界使用。不过,疫苗和任何新药一样,都需要经过临床试验的检验才能获得批准。之所以有超过90%的新疫苗研发最后都跑不到终点,主要问题就出在这一步。
前期疫苗
当今世界,任何一种新药,无论原理多么简单,逻辑多么严谨,都必须经过严格的临床试验才能获得批准,这是现代医学和传统医学最大的区别。疫苗本质上属于药物,自然也必须先通过临床试验才能上市。
通常情况下,一种新的疫苗先要在动物身上做试验,确认没有急性毒性之后才能开始人体试验。人体临床试验分为3期,Ⅰ期临床通常只招募几十人,主要看疫苗是否有急性毒性,以及摸索合适的接种剂量。Ⅱ期临床通常会招募几百人,一方面继续观察疫苗毒性和可能出现的副作用,另一方面考察疫苗是否具备最基本的药理特性。
我们可以把这一阶段的临床试验称为前期临床,一般情况下需要耗时5年才能完成。但因为很多新冠疫苗都沿用了当年“非典”疫苗的技术路线,甚至连疫苗载体都完全一样,所以药监部门允许制药厂省略动物实验,并将Ⅰ期和Ⅱ期合并,最大限度地节省时间。这件事再次说明当年的“非典”疫苗研究没有白费,很多数据都可以照搬到新冠上来。
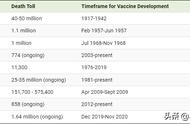
根据加拿大麦吉尔大学相关团队在新冠疫苗专题网站上的统计数据,截止2022年12月1日,全世界已经有242中疫苗进入临床试验阶段,另有821种疫苗进入研发阶段。而早在2020年10月,如今已经较为出名的多款新冠疫苗就已完成Ⅱ 期临床,均诱导出了强烈的免疫应答,不良反应率也都在可控的范围之内,只是激发出免疫应答所需的时间、中和抗体的滴度,以及副作用的强弱等等细微指标存在差异,而且各有千秋。
具体来说,在中和抗体滴度方面,美国莫德纳和德国BioNTech的mRNA疫苗表现最好,国药集团和科兴中维的3种灭活疫苗次之,牛津大学和康希诺的腺病毒载体疫苗最低,但也高于实际患者的抗体滴度,说明这几款疫苗理论上都具备了保护效力。在不良反应方面,灭活疫苗表现最好,腺病毒载体疫苗次之,mRNA疫苗的不良反应率最高,说明这类需要进入接种者细胞内才能发挥作用的核酸类疫苗所激发的免疫反应很可能要更强一些。不过,由于各家公司所采用的衡量标准有差异(比如美国临床试验的发热标准是38℃以上,而我国的发热标准为37.3℃以上),不同疫苗Ⅱ期临床数据之间的横向比较价值不大,没有必要花太多时间进行解读。

科研人员展示新型冠状病毒mRNA疫苗研发实验过程( 汤彦俊 摄/人民视觉供图)
但有一个细节值得注意,那就是康希诺的腺病毒载体疫苗诱导出来的免疫反应强度要比牛津大学的同类疫苗弱一些,原因很可能是因为康希诺用的是一种常见的人类腺病毒作为疫苗载体,不少人此前感染过这种腺病毒,体内已经有了专门针对它的抗体,导致这种疫苗刚进入人体后就被免疫系统识别了出来,并对其发动了攻击,“送信”任务因此也就完不成了,未来很可能需要通过补种的办法来加强疫苗效果。相比之下,牛津疫苗用的是一种黑猩猩腺病毒载体,人类对它没有免疫力,因此它的“送信”任务就完成得更好。
像这样的小细节很难在实验室里被发现,这就是人体试验的价值所在。