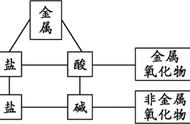
① 酸的通性
1、 酸使指示剂变色;
2、 酸 碱===== 盐 水
3HCl Al(OH)3==== AlCl3 3H2O(用胃舒平治疗胃酸过多)
H2SO4 2 NaOH==== Na2SO4 H2O
3、 酸 某些盐===== 新盐 新酸
2HCl CaCO3====CaCl2 H2O CO2↑ (实验室制取CO2)
HCl AgNO3==== AgCl ↓ HNO3 (用AgNO3溶液和稀硝酸检验盐酸)
H2SO4 BaCl2==== BaSO4 ↓ 2HCl (用BaCI2溶液和稀硝酸检验硫酸)
4、 酸 金属氧化物==== 盐 水
6HCl Fe2O3====2 FeCl3 3 H2O (用稀盐酸清除铁锈,铁锈溶解,形成黄色溶液)
H2SO4 CuO ==== CuSO4 H2O (氧化铜黑色粉末溶解,形成蓝色溶液)
5、 酸 某些金属==== 盐 氢气
Fe 2HCl ==== FeCl2 H2↑
Zn H2SO4==== ZnSO4 H2↑(实验室用于制H2)
酸的个性
1、盐酸HCl:
盐酸是HCl气体的水溶液,具有挥发性,挥发出的HCl气体在瓶口遇水蒸汽形成盐酸的小液滴而出现白雾。浓盐酸敞口放置会使质量减轻,浓度变小。工业盐酸因常含Fe3 而显黄色。
2、硫酸H2SO4:
(1)浓硫酸有很强的腐蚀性,皮肤不慎沾上浓硫酸后,应立即用干布拭去,再用大量的水冲洗,最后用小苏打溶液冲洗。
(2)浓硫酸的稀释:将浓硫酸沿着烧杯内壁漫漫流进水中,并不断用玻璃棒搅拌,使产生的热量迅速散失。极易溶于水放出大量的热。
(3)浓硫酸的脱水性:使纸上字迹变黑。
(4)浓硫酸的吸水性:可做某些气体的干燥剂。浓硫酸敞口放置使质量增加,浓度变小。
② 碱的通性
(一)
1、碱:电离时生成的阴离子全部是OH—的化合物。
NaOH ==== Na OH— Ca(OH)2====Ca2 2OH—
2、四种可溶性碱:NaOH KOH Ca(OH)2 Ba(OH)2
3、碱使指示剂变色;
4、碱 酸===== 盐 水
Ca(OH)2 2 HCl ===== CaCl2 2H2O
中和反应:酸和碱反应,生成盐和水的反应。(实验时用酸碱指示剂指示酸、碱是否恰好完全反应)。
3、碱 某些非金属氧化物===== 盐 水
2NaOH CO2==== Na2CO3 H2O
Ca(OH)2 CO2==== CaCO3↓ H2O(CO2能使澄清石灰水变浑浊,以此检验CO2)
2NaOH SO2 ==== Na2SO3 H2O (工业上用碱溶液吸收SO2等有害气体)
4、碱 某些盐===== 新碱 新盐
3NaOH FeCl3==== Fe(OH)3↓ 3NaCl (生成红褐色沉淀)
2NaOH CuSO4====Ca(OH)2 ↓ Na2SO4 (生成兰色沉淀)
Ca(OH)2 Na2CO3==== CaCO3↓ 2NaOH (工业上制取NaOH )
(二)碱的个性
1、氢氧化钠NaOH :
(1)俗称:烧碱、苛性钠。
(2)易潮解,易和空气中CO2反应而变质,故应密封保存。
2NaOH CO2==== Na2CO3 H2O
(3)极易溶于水,放出大量的热。
2、氢氧化钙Ca(OH)2 :
(1)俗称:熟石灰、消石灰。
(2)区分NaOH和Ca(OH)2两种溶液的方法:
方法一:分别通入CO2,变浑浊的是Ca(OH)2溶液;
Ca(OH)2 CO2==== CaCO3↓ H2O
方法二:分别加入Na2CO3溶液,产生白色沉淀的是Ca(OH)2溶液。
Ca(OH)2 Na2CO3==== CaCO3↓ 2NaOH
③ 盐
1、 盐:由金属离子(或NH4 )和酸根离子组成的化合物。
2、盐的分类:盐酸盐(氯化物) NaCI 、CaCl2等
硫酸盐 Na2SO4 、CuSO4等 碳酸盐 Na2CO3 、CaCO3 、BaCO3等
硝酸盐 KNO3 、 Ba(NO3)2等 铵盐 NH4Cl 、(NH4)2SO4等
3、盐的溶解性:
钾、钠、硝、铵均可溶; 盐酸只有Ag不溶;
硫酸只有Ba不溶; 碳酸只溶钾、钠、铵可溶。
(一)几种重要的盐
1、碳酸钠Na2CO3:俗称纯碱。晶体化学式为Na2CO3·10H2O ,在干燥的空气中容易失去结晶水变成粉末。Na2CO3虽然是盐,但水溶液却显碱性,因而俗称纯碱。
2、碳酸钙CaCO3:俗称大理石或石灰石。做建筑材料。
3、氯化钠NaCI :俗称食盐。
(二)盐的通性
1、某些盐和酸的反应;
Na2CO3 2 HCI==== 2NaCI H2O CO2↑
2、某些盐和碱的反应;
Na2CO3 Ca(OH)2==== CaCO3↓ 2NaOH (工业上制取NaOH )
3、盐和某些盐的反应;
NaCI AgNO3==== AgCI↓ NaNO3 Na2SO4 BaCI2==== BaSO4↓ 2 NaCI
Na2CO3 CaCI2==== CaCO3 ↓ 2NaCI
(三)复分解反应及其能否发生的条件
1、复分解反应:两种化合物相互交换成分,生成两种新化合物的反应。如:
Na2CO3 Ca(OH)2==== CaCO3↓ 2NaOH
2、复分解反应发生的必要条件:
反应物中有酸可不溶,无酸都要溶,生成物要有沉淀或水或气体生成。
(四)化学肥料(按含N、P、K等营养元素分类)
1、 氮肥(N):NH4CI 、(NH4)2SO4等。能促使作物茎叶生长茂盛。
2、 磷肥(P):Ca(H2PO4)2等。使作物根系发达,增强抗旱和抗寒能力,蟪粒增多,子粒饱满。
3、 钾肥(K):草木灰K2CO3等。能使作物生长旺盛,茎杆粗壮,增强抗病能力促进糖和淀粉的生成。
4、复合肥:含N、P、K元素中的两种或三种,如KNO3
,