光合作用分为光反应和卡尔文循环(暗反应)两个阶段,其中卡尔文循环包括多步酶促反应,利用光反应过程中产生的ATP和NADPH固定二氧化碳,生成碳水化合物。因此尽管卡尔文循环不需要光能,但该过程仍受到光/暗调控。光反应阶段中光信号经由一系列蛋白最终转变为氧化还原信号,通过硫氧还蛋白(TRX)调控卡尔文循环及大量下游反应。叶绿体磷酸核酮糖激酶(PRK)和甘油醛-3-磷酸脱氢酶(GAPDH)是卡尔文循环的关键酶,分别消耗光反应过程中产生的ATP和NADPH,并均受到TRX的氧化还原调控,处于还原态时为激活状态,氧化态时为失活状态。此外,叶绿体中另一个蛋白CP12也受TRX调控,并能在氧化状态下与PRK、GAPDH相互作用形成GAPDH/CP12/PRK复合物。复合物形成后,两个酶的活性均进一步受到抑制。
5月8日,国际植物研究杂志THE PLANT CELL 发表了中国科学院生物物理研究所李梅/常文瑞组的研究成果,题为Photosynthetic Phosphoribulokinase Structures: Enzymatic Mechanisms and the Redox Regulation of the Calvin-Benson-Bassham Cycle,揭示了光合作用卡尔文循环(暗反应)中PRK的催化反应机制,并为卡尔文循环受光照/黑暗调控的机理提供了结构基础。
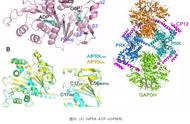
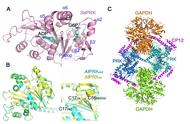
该项工作中,研究人员解析了PRK及其复合物的晶体结构,包括来源于蓝藻的PRK结合辅因子二磷酸腺苷(ADP)和葡萄糖-6-磷酸(G6P)的晶体结构,分别处于氧化态和还原态的拟南芥PRK的晶体结构,以及拟南芥PRK与GAPDH、CP12形成的GAPDH/CP12/PRK复合物的晶体结构。基于结构信息,结合突变体测活与亲和力实验结果,确定了PRK的活性位点以及参与催化的关键结构域和氨基酸,解释了PRK受氧化还原调控的分子机理,展示了GAPDH/CP12/PRK复合物中各蛋白之间相互作用的具体细节,并揭示了CP12响应氧化还原信号调控PRK及GAPDH活性的作用机制。这些研究结果为深入理解PRK的催化机理以及卡尔文循环的精细调控提供了重要结构信息。
生物物理所研究员李梅为论文的通讯作者,博士生于爱玲和博士解媛为该项工作的共同第一作者。该研究工作得到科技部重点研发计划、中科院B类先导专项、中科院前沿科学重点研究项目、国家自然科学基金的共同资助。数据收集和样品分析等工作得到上海光源、生物物理所蛋白质科学研究平台等有关工作人员的支持和帮助。
图示:(A) SePRK-ADP-G6P结构;(B) AtPRKox和AtPRKred结构比对;(C) GAPDH/CP12/PRK复合物三维结构。
,