高考化学资料汇总
1:各种"水"汇集
(一)纯净物:
重水D2O;超重水T2O;蒸馏水H2O;双氧水H2O2;水银Hg;水晶SiO2。
(二)混合物:
氨水(分子:NH3、H2O、NH3·H2O;离子:NH4 、OH‾、H )
氯水(分子:Cl2、H2O、HClO;离子:H 、Cl‾、ClO‾、OH‾)
王水(浓HNO3∶浓HCl=1∶3溶质的体积比) 卤水(MgCl2、NaCl及少量MgSO4)
硬水(溶有较多量Ca2 、Mg2 的水) 软水(溶有较少量或不溶有Ca2 、Mg2 的水)
铁水(Fe、C、Mn、Si、S、P等单质的熔融态混合体)
苏打水(Na2CO3的溶液) 生理盐水(0.9%的NaCl溶液) 硝(盐)镪水[浓硝(盐)酸]
水玻璃(Na2SiO3水溶液) 水泥(2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3)
2:各种"气"汇集
(1) 无机的:爆鸣气(H2与O2);水煤气或煤气(CO与H2);高炉气或高炉煤气(CO、CO2、N2)
笑气(N2O) 碳酸气(CO2)
(二)有机的:天然气(又叫沼气、坑气,主要成分为CH4) 电石气(CH≡CH,常含有H2S、PH3等)
裂化气(C1~C4的烷烃、烯烃) 裂解气(CH2=CH2、CH3CH=CH2、CH2=CHCH=CH2等)
焦炉气(H2、CH4等) 炼厂气(C1~C4的气态烃,又叫石油气、油田气。)
3:氧化物的分类
(一)氧化物的分类:成盐氧化物:酸性氧化物、碱性氧化物、两性氧化物、复杂氧化物(过氧化物、超氧化物、Fe3O4、Pb3O4等);不成盐氧化物CO、NO
(二)易混淆概念分辨
酸酐不一定是酸性氧化物:如乙酸酐酐(CH3CO)2O等;酸性氧化物一定是酸酐。
非金属氧化物不一定是酸性氧化物:如NO、CO、NO2、N2O4、H2O
酸性氧化物不一定是非金属氧化物:如Mn2O7、CrO3
金属氧化物不一定是碱性氧化物:如Al2O3、ZnO(两性),Mn2O7、CrO3(酸性氧化物)
碱性氧化物一定是金属氧化物
※NO2因与碱反应不仅生成盐和水,还有NO,因而不是酸性氧化物。
※Na2O2因与酸反应不仅生成盐和水,还有O2,因而不是碱性氧化物。
4:比较金属性强弱的依据
5:比较非金属性强弱的依据
1、同周期中,从左到右,随核电荷数的增加,非金属性增强; 同主族中,由上到下,随核电荷数的增加,非金属性减弱;
2、依据最高价氧化物的水化物酸性的强弱:酸性愈强,其元素的非金属性也愈强;
3、依据其气态氢化物的稳定性:稳定性愈强,非金属性愈强;
4、与氢气化合的条件;5、与盐溶液之间的置换反应;
6、其他,例:2Cu+S , Cu+Cl2 所以,Cl的非金属性强于S。
6:"10电子"、"18电子"的微粒小结
分子 离子
一核10电子的 Ne N3−、O2−、F−、Na 、Mg2 、Al3
二核10电子的 HF OH- 三核10电子的 H2O NH2-
四核10电子的 NH3 H3O 五核10电子的 CH4 NH4
分子 离子
一核18电子的 Ar K 、Ca2 、Cl‾、S2−
二核18电子的 HCl HS- 三核18电子的 H2S、F2
四核18电子的 PH3 五核18电子的 SiH4 、CH3F PH4
六核18电子的 N2H4、CH3OH 注:其它诸如C2H6、N2H5 、N2H62 等亦为18电子的微粒。
7:具有漂白作用的物质
氧化作用:Cl2、O3、Na2O2、浓HNO3;化学变化;不可逆
化合作用:SO2;化学变化;可逆 吸附作用:活性炭;物理变化;可逆
※其中能氧化指示剂而使指示剂褪色的主要有Cl2(HClO)和浓HNO3及Na2O2
8:安全火柴的成分及优点
安全火柴的成分:火柴头:氧化剂(K、MnO2)、易燃物(如硫等)、粘合剂
火柴盒侧面:红磷、三硫化二锑、粘合剂 起火原因:摩擦→发热→KClO3分解→使红磷着火→引起火柴头上的易燃物(如硫)燃烧。 优点:红磷与氧化剂分开,比较安全,无毒性。
9:能升华的物质
I2、干冰(固态CO2)、升华硫、红磷,萘。(蒽和苯甲酸作一般了解)。
10:能被活性炭吸附的物质
1、有毒气体(NO2、Cl2、NO等)——去毒;
2、 色素——漂白; 3、水中有臭味的物质——净化。
11:硅及其化合物十"反常"
1、硅的还原性比碳强,而碳在高温下却能从二氧化硅中还原出硅。SiO2+2C=Si+2CO↑
2、非金属单质一般不与弱氧化性酸反应,而硅不但能与HF反应,而且还有H2生成。Si+4HF=SiF4↑+2H2↑
3、非金属单质与强碱溶液反应一般不生成氢气,而硅却不然。Si+2NaOH+H2O==Na2SiO3+2 H2↑
4、虽然SiO2是硅酸的酸酐,但却不能用SiO2与水反应制备硅酸,只能用可溶性硅酸盐跟酸作用来制备。
5、酸性氧化物一般不与酸反应(除氧化还原反应外),而二氧化硅却能与氢氟酸反应。
6、非金属氧化物一般是分子晶体,而二氧化硅却是原子晶体。
7、无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。
8、通常所说的某酸盐为一种酸根的盐,而硅酸盐却是多种硅酸(H2SiO3、H4SiO4、H2Si2O5、H6Si2O7等)的盐的总称。
9、较强的酸能把较弱的酸从其盐溶液中制取出来,这是复分解反应的一般规律,由此对于反应Na2SiO3+CO2+H2O==Na2CO3+H4SiO4↓的发生是不难理解的,而反应Na2CO3+SiO2=Na2SiO3+CO2↑居然也能进行。
10、硅酸钠的水溶液俗称水玻璃,但它和玻璃的化学成分并不相同。硅酸钠也叫泡花碱,但它是盐而不是碱。钢化玻璃与普通玻璃成分相同,水晶玻璃与玻璃成分不同。
12:碱金属元素具体知识的一般与特殊
1、Na、K均保存在煤油中,防止氧化,但锂单质不能保存在煤油中,因锂单质密度小于煤油,浮于煤油液面,达不到隔绝空气的目的,应保存太平石蜡中。
2、碱金属单质的密度一般随核电荷数的增大而增大,但钾的密度却比钠小。
3、碱金属单质在空气中燃烧大部分生成过氧化物或超氧化物,但锂单质特殊,燃烧后的产物只是普通氧化物。
4、碱金属单质和水反应时,碱金属一般熔点较低,会熔化成小球。但锂的熔点高,不会熔成小球。生成的LiOH溶解度较小,覆盖在锂的表面,使锂和水的反应不易连续进行。
5、碱金属单质和水反应时,碱金属单质一般浮于水面上,但铷、铯等单质和水反应时沉入水底,因铷、铯单质的密度比水大。
6、钠盐的溶解度受温度的变化影响一般都较大,但NaCl的溶解度受温度变化的影响却很小。
7、碱金属的盐一般均易溶于水,但Li2CO3却微溶于水。
8、焰色反应称为"反应",但却是元素的一种物理性质。
13:Fe3 的颜色变化
1、向FeCl3溶液中加几滴KSCN溶液呈红色;2、FeCl3溶液与NaOH溶液反应,生成红褐色沉淀;
3、向FeCl3溶液溶液中通入H2S气体,生成淡黄色沉淀;
4、向FeCl3溶液中加入几滴Na2S溶液,生成淡黄色沉淀;当加入的Na2S溶液过量时,又生成黑色沉淀;
5、向FeCl3溶液中加入过量Fe粉时,溶液变浅绿色;
6、向FeCl3溶液中加入过量Cu粉,溶液变蓝绿色; 7、将FeCl3溶液滴入淀粉KI溶液中,溶液变蓝色;
8、向FeCl3溶液中滴入苯酚溶液,溶液变紫色;
14:"黑色金属"有哪些
化学上把铁、铬、锰三种金属和铁基合金统称为"黑色金属"。
15:Fe2 与Fe3 的鉴别方法
Fe2 与Fe3 的性质不同而又可以相互转化。中学化学中可用以下几种方法加以鉴别。
1.观察法:其溶液呈棕黄色者是Fe3 ,呈浅绿色者是Fe2 。
2.H2S法:通往H2S气体或加入氢硫酸,有浅黄色沉淀析出者是Fe3 ,而Fe2 溶液 不反应。2Fe3 +H2S==2Fe2 +2H +S↓
3.KSCN法:加入KSCN或其它可溶性硫氰化物溶液,呈血红色者是Fe3 溶液,而Fe2 的溶液无此现象。这是鉴别鉴别Fe3 与Fe2 最常用、最灵敏的方法。Fe3 +SCN−==[Fe(SCN)]2
4.苯酚法:分别加入苯酚溶液,显透明紫色的是Fe3 溶液,无此现象的是Fe2 的溶液。Fe3 +6C6H5OH→[Fe(C6H5O)6]3−+6H (了解)
5.碱液法:取两种溶液分别通入氨气或碱液,生成红褐色沉淀的是Fe3 溶液,生成白色沉淀并迅速变为灰绿色、最终变成红褐色的是Fe2 溶液。 Fe3 +3NH3·H2O==Fe(OH)3↓+3NH4 ;
Fe3 +3OH‾== Fe(OH)3↓ Fe2 +2 NH3·H2O==Fe(OH)2↓+2NH4 ;4 Fe(OH)2+2H2O+O2==4 Fe(OH)3
6.淀粉KI试纸法:能使淀粉KI试纸变蓝的是Fe3 溶液,无变化的是Fe3 溶液。2 Fe3 +2I‾==2 Fe2 +I2
7.铜片法:分别加入铜片,铜片溶解且溶液渐渐变为蓝色的是Fe3 溶液,无明显现象的是Fe2 溶液。
2 Fe3 +Cu==2 Fe2 +Cu2
8.KMnO4法:分别加入少量酸性KMnO4溶液,振荡,能使KMnO4溶液紫红色变浅的是Fe2 溶液,颜色不变浅的是Fe3 溶液。5 Fe2 +MnO4−+8H ==5 Fe3 +Mn2 +4H2O
16:金属的冶炼规律
1.活泼金属的冶炼 钠、镁、铝等活泼金属,采用电解其熔融态的卤化物的方法冶炼(通直流电)。
例如:2NaCl(熔融) 2Na+Cl2↑ MgCl2熔融) Mg+Cl2↑
2Al2O3(熔融) 4Al+3O2↑(加入Na3AlF6作熔剂)
注:这里为何不电解熔融态铝的氯化物而须电解其熔融态的氧化物,读者应掌握AlCl3为共价化合物,熔融态时不电离,而Al2O3为离子化合物,熔融态时可发生电离的道理。
2.中等活泼的金属的冶炼 锌、铁、锡、铅等中等活泼的金属采用还原剂还原它们的氧化物的方法冶炼。
例如:ZnO+C Zn+CO↑ Fe2O3+3CO 2Fe+3CO2 WO3+3H2 W+3H2O
Cr2O3+2Al 2Cr+Al2O3
3.不活泼金属的冶炼 银、铂、金等不活泼金属在自然界可以游离态存在,直接采用物理方法(如淘金等)冶炼,而铜、汞等不活泼金属可用还原剂还原法或热分解法冶炼。例如:2HgO 2Hg+O2↑
17:"置换反应"有哪些?
1.较活泼金属单质与不活泼金属阳离子间置换 如:Zn+Cu2 ==Zn2 +Cu Cu+2Ag =2Ag
2、活泼非金属单质与不活泼非金属阴离子间置换Cl2 2Br‾==2Cl‾ Br2
I2 S2−==2I‾ S 2F2+2H2O==4HF+O2
3、 活泼金属与弱氧化性酸中H 置换 2Al+6H ==2Al3−+3H2↑
Zn+2CH3COOH==Zn2 +2CH3COO‾+H2↑
4、金属单质与其它化合物间置换 2Mg+CO2 2MgO+C
2Mg+SO2 2MgO+S Mn+FeO MnO+Fe 2Na+2H2O==2Na +2OH‾+H2↑
2Na+2C6H5OH(熔融)→2C6H5ONa+H2↑ 2Na+2C2H5OH→2C2H5ONa+H2↑
10Al+3V2O5 5Al2O3+6V 8Al+3Fe3O4 4Al2O3+9Fe
2FeBr2+3Cl2==2FeCl3+2Br2 2FeI2+ 3Br2==2FeBr3+2I2 Mg+2H2O Mg(OH)2+H2↑
3Fe+4H2O(气) Fe3O4+4 H2↑
5、 非金属单质与其它化合物间置换 H2S+X2==S↓+2H +2X‾
2H2S+O2 2S+2H2O(O2不足) CuO+ C Cu+CO↑ (C过量时)
2 CuO+C 2Cu+CO2↑ (CuO过量时) FeO+ C Fe+CO↑
2FeO+Si SiO2+2Fe↑ 2FeO+C 2Fe+CO2↑ CuO+H2 Cu+H2O
Cu2O+H2 2Cu+H2O SiO2+2C Si+2CO↑ 3Cl2+8NH3==6NH4Cl+N2
3Cl2+2NH3==6HCl+N2
18:条件不同,生成物则不同
1、2P+3Cl2 2PCl3(Cl2不足) ;2P+5Cl2 2PCl5(Cl2充足)
2、2H2S+3O2 2H2O+2SO2(O2充足) ;2H2S+O2 2H2O+2S(O2不充足)
3、4Na+O2 2Na2O 2Na+O2 Na2O2
4、Ca(OH)2+CO2 (适量)== CaCO3↓+H2O ;Ca(OH)2+2CO2(过量)==Ca(HCO3)2↓
5、2Cl2+2 Ca(OH)2==Ca(ClO)2+CaCl2+2H2O 6Cl2+6 Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O
6、C+O2 CO2(O2充足) ;2C+O2 2CO (O2不充足)
7、8HNO3(稀)+3Cu==2NO↑+2Cu(NO3)2+4H2O 4HNO3(浓)+ Cu==2NO2↑+Cu(NO3)2+2H2O
8、NaCl(固)+H2SO4 (浓)NaHSO4+HCl↑ 2NaCl(固)+H2SO4 (浓)Na2SO4+2HCl↑
9、 H3PO4+ NaOH==NaH2PO4+H2O;H3PO4+2NaOH==Na2HPO4+2H2O
H3PO4+3NaOH==Na3PO4+3H2O
10、AlCl3+3NaOH==Al(OH)3↓+3NaCl ; AlCl3+4NaOH(过量)==NaAlO2+2H2O
11、NaAlO2+4HCl(过量)==NaCl+2H2O+AlCl3;NaAlO2+HCl+H2O==NaCl+Al(OH)3↓
12、Fe+6HNO3(热、浓)==Fe(NO3)3+3NO2↑+3H2O;Fe+HNO3(冷、浓)→(钝化)
13、Fe+6HNO3(热、浓) Fe(NO3)3+3NO2↑+3H2O;Fe+4HNO3(热、浓) Fe(NO3)2+2NO2↑+2H2O
14、Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;3Fe+8HNO3(稀)=3Fe(NO3)3+2NO↑+4H2O
15、C2H5OH CH2=CH2↑+H2O C2H5-OH+HO-C2H5 C2H5-O-C2H5+H2O
16.苯与氯气反应
17、C2H5Cl+NaOH C2H5OH+NaCl C2H5Cl+NaOH CH2=CH2↑+NaCl+H2O
18、6FeBr2+3Cl2(不足)==4FeBr3+2FeCl3 2FeBr2+3Cl2(过量)==2Br2+2FeCl3
19:滴加顺序不同,现象不同
1、AgNO3与NH3·H2O:AgNO3向NH3·H2O中滴加——开始无白色沉淀,后产生白色沉淀
· NH3·H2O向AgNO3中滴加——开始有白色沉淀,后白色沉淀消失
2、Ca(OH)2与H3PO4(多元弱酸与强碱反应均有此情况):
Ca(OH)2向H3PO4中滴加——开始无白色沉淀,后产生白色沉淀
H3PO4向Ca(OH)2中滴加——开始有白色沉淀,后白色沉淀消失
3、NaOH与AlCl3:NaOH向AlCl3中滴加——开始有白色沉淀,后白色沉淀消失
· AlCl3向NaOH中滴加——开始无白色沉淀,后产生白色沉淀
4、HCl与NaAlO2:HCl向NaAlO2中滴加——开始有白色沉淀,后白色沉淀消失
· NaAlO2向HCl中滴加——开始无白色沉淀,后产生白色沉淀
5、Na2CO3与盐酸:Na2CO3向盐酸中滴加——开始有气泡,后不产生气泡
· 盐酸向Na2CO3中滴加——开始无气泡,后产生气泡
20:有关"燃烧"的总结
(一)"燃烧"的条件:
1.温度达到着火点;2.有助燃剂(多指在反应中的氧化剂)
(二)镁在哪些气体中能燃烧?
1.镁在空气(氧气)中燃烧:2Mg+O2 2MgO 现象:产生白烟,发出耀眼的强光。
2.镁在氯气中燃烧:Mg+Cl2 MgCl2 现象:产生白烟。
3.镁在氮气中燃烧:3Mg+N2 Mg3N2 现象:产生灰黄色烟。
4.镁在CO2气体中燃烧:2Mg+CO2 2MgO+C现象:产生白烟,瓶壁上有少许淡黄色物质。
(三)火焰颜色小结:
H2在空气中燃烧(淡蓝色);CH4在空气中燃烧(淡蓝色);C2H4在空气中燃烧(火焰明亮,黑烟)
C2H2在空气中燃烧(浓烈的黑烟);H2S在空气中燃烧(淡蓝色);C2H5OH在空气中燃烧(淡蓝色)
S在空气中燃烧(淡蓝色);S在纯氧中燃烧(蓝紫色);CO在空气中燃烧(淡蓝色)
H2在Cl2中燃烧(苍白色)
此外:含钠元素的物质焰色呈黄色;含钾元素的物质焰色呈紫色(透过蓝色钴玻璃片)
21:关于化工生产的小结
有关教材中化工生产的内容概括如下两表格,阅读时还应注意:
1. 制玻璃和制水泥三工业都用到了石灰石;
2. 接触法制硫酸和硝酸的工业制法共同用到的设备是吸收塔;
3. 接触法制硫酸、硝酸的工业制法、炼铁(炼钢)都需要鼓入过量空气;
4. 炼铁和炼钢的尾气中均含有可燃性气体CO。
主要原料、化工生产原理与设备
接触法制硫酸 主要原料:硫铁矿、空气、98.3%的浓H2SO4
化工生产原理:增大反应物的浓度、逆流、增大反应物间的接触面积 设备:沸腾炉、接触室、吸收塔
硝酸的工业制法 主要原料:氨、水、空气
化工生产原理:反应物的循环操作、增大反应物的浓度、逆流 设备:氧化炉、吸收塔
制玻璃 主要原料:石灰石、纯碱和石英 设备:玻璃熔炉
制水泥 主要原料:石灰石和粘土 设备:水泥回转窑
化工生产原理及环境污染问题
生产名称 反应方程式 环境污染有关内容
接触法制硫酸4FeS2+11O2 = 2Fe2O3+8SO2 (高温) 产生的SO2形成"酸雨"
2SO2+O2 = 2SO3(V2O5、△) 造成污染。用氨水吸收①
SO3+H2O=H2SO4
硝酸的工业制法 4NH3+5O2=4NO+6H2O(Pt、△) 产生的NO、NO2
· 2NO+O2=2NO2(放电) 造成污染,用碱液吸收②
· 3NO2 H2O=2HNO3+NO
制玻璃 Na2CO3+SiO2= Na2SiO3+CO2(高温) CaCO3+SiO2 = CaSiO3+CO2(高温)
制水泥 是化学变化,方程式不掌握
注:①SO2+NH3+H2O==NH4HSO3 ②NO+NO2+2NaOH==2NaNO2+H2O
玻璃成分Na2SiO3 、 CaSiO3、SiO2 水泥成分2CaO·SiO2 、3CaO·SiO2 、3CaO·Al2O3
22:关于气体的全面总结
1.常见气体的制取和检验:(此处略)
2.常见气体的溶解性: 极易溶的:NH3(1∶700) 易溶的:HX、HCHO、SO2(1∶40)
能溶的或可溶的:CO2(1∶1)、Cl2(1∶2.26)、H2S(1∶2.6) 微溶的:C2H2
难溶或不溶的:O2、H2、CO、NO、CH4、CH3Cl、C2H6、C2H4 与水反应的:F2、NO2。
3.常见气体的制取装置:
能用启普发生器制取的:CO2、H2、H2S;
能用加热略微向下倾斜的大试管装置制取的:O2、NH3、CH4;
能用分液漏斗、圆底烧瓶的装置制取的:Cl2、HCl、SO2、CO、NO、NO2、C2H4等。
4.有颜色的气体:F2(淡黄绿色)、Cl2(黄绿色)、NO2(红棕色)
5.具有刺激性气味的:F2、Cl2、Br2(气)、HX、SO2、NO2、NH3、HCHO。臭鸡蛋气味的:H2S。
稍有甜味的:C2H4。
6.能用排水法收集的:H2、O2、CO、NO、CH4、C2H4、C2H2。
7.不能用排空气法收集的:CO、N2、C2H4、NO、C2H6。
8.易液化的气体:Cl2、SO2、NH3。 9.有毒的气体:Cl2、F2、H2S、SO2、NO2、CO、NO。
10.用浓H2SO4制取的气体:HF、HCl、CO、C2H4。
11.制备时不需加热的:H2S、CO2、H2、SO2、NO、NO2、C2H2。
12.能使湿润的蓝色石蕊试纸变红的:HX、SO2、H2S、CO2。
13.能使湿润的红色石蕊试纸变蓝的:NH3 14.能使品红试液褪色的:Cl2、SO2、NO2
15.能使酸性KMnO4溶液褪色的:H2S、SO2、HBr、HI、C2H4、C2H2
16.能使湿润的醋酸铅试纸变黑的:H2S 17.不能用浓H2SO4干燥的:H2S、HBr、HI、NH3
18.不能用碱石灰干燥的:Cl2、HX、SO2、H2S、NO2、CO2
19.不能用氯化钙干燥的:NH3、C2H5OH
23:最简式相同的有机物
1.CH:C2H2和C6H6 2.CH2:烯烃和环烷烃 3.CH2O:甲醛、乙酸、甲酸甲酯
4.CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数的饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)
5.炔烃(或二烯烃)与三倍于其碳原子数的苯及苯的同系物;举一例:丙炔(C3H4)与丙苯(C9H12)
24:有机物之间的类别异构关系
1. 分子组成符合CnH2n(n≥3)的类别异构体:烯烃和环烷烃;
2. 分子组成符合CnH2n-2(n≥4)的类别异构体:炔烃和二烯烃;
3. 分子组成符合CnH2n+2O(n≥3)的类别异构体:饱和一元醇和醚;
4. 分子组成符合CnH2nO(n≥3)的类别异构体:饱和一元醛和酮;
5. 分子组成符合CnH2nO2(n≥2)的类别异构体:饱和一元羧酸和酯;
· 分子组成符合CnH2n-6O(n≥7)的类别异构体:苯酚的同系物、芳香醇及芳香
25:能发生取代反应的物质及反应条件
1.烷烃与卤素单质:卤素蒸汽、光照;
2.苯及苯的同系物:与①卤素单质:Fe作催化剂;②浓硝酸:50~60℃水浴;浓硫酸作催化剂③浓硫酸:70~80℃水浴;共热
3.卤代烃水解:NaOH的水溶液; 4.醇与氢卤酸的反应:新制的氢卤酸、浓硫酸共热
5.酯化反应:浓硫酸共热 6.酯类的水解:无机酸或碱催化;7.酚与浓溴水或浓硝酸
8.油酯皂化反应 9.(乙醇与浓硫酸在140℃时的脱水反应,事实上也是取代反应。)
26:能发生加成反应的物质
烯烃的加成:卤素、H2、卤化氢、水 炔烃的加成:卤素、H2、卤化氢、水
二烯烃的加成:卤素、H2、卤化氢、水 苯及苯的同系物的加成:H2、Cl2
苯乙烯的加成:H2、卤化氢、水、卤素单质
不饱和烃的衍生物的加成:(包括卤代烯烃、卤代炔烃、烯醇、烯醛、烯酸、烯酸酯、烯酸盐等)
含醛基的化合物的加成:H2、HCN等 酮类物质的加成:H2
油酸、油酸盐、油酸某酯、油(不饱和高级脂肪酸甘油酯)的加成。
27:能发生加聚反应的物质
烯烃、二烯烃、乙炔、苯乙烯、烯烃和二烯烃的衍生物。
28:能发生缩聚反应的物质
1.苯酚和甲醛:浓盐酸作催化剂、水浴加热 2.二元醇和二元羧酸等
29:能发生银镜反应的物质
凡是分子中有醛基(-CHO)的物质均能发生银镜反应。
1.所有的醛(R-CHO);2.甲酸、甲酸盐、甲酸某酯;
注:能和新制Cu(OH)2反应的——除以上物质外,还有酸性较强的酸(如甲酸、乙酸、丙酸、盐酸、硫酸、氢氟酸等),发生中和反应。
30:能跟钠反应放出H2的物质
A.有机:1.醇(+K、Mg、Al);2.有机羧酸;3.酚(苯酚及同系物);4.苯磺酸;5.苦味酸
B,无机:1.水及水溶液; 2.无机酸(弱氧化性酸); 3.NaHSO4
注:其中酚、羧酸能与NaOH反应;也能与Na2CO3反应;羧酸能与NaHCO3反应;醇钠、酚钠、羧酸钠水溶液都因水解呈碱性
31:能与溴水反应而使溴水褪色或变色的物质
(一)有机 1.不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);2.不饱和烃的衍生物(烯醇、烯醛、油酸、油酸盐、油酸某酯、油等);3.石油产品(裂化气、裂解气、裂化汽油等);4.苯酚及其同系物(因为能与溴水取代而生成三溴酚类沉淀);5.含醛基的化合物;6.天然橡胶(聚异戊二烯);7.能萃取溴而使溴水褪色的物质,上层变无色的(ρ>1):卤代烃(CCl4、氯仿、溴苯等)、CS2;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、液态环烷烃、低级酯、液态饱和烃(如已烷等)等
(二)无机1.-2价硫(H2S及硫化物);2.+4价硫(SO2、H2SO3及亚硫酸盐);3.+2价铁:6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3;6FeCl2+3Br2=4FeCl3+2FeBr3;2FeI2+3Br2=2FeBr3+2I2(以上变色)4.Zn、Mg等单质 如Mg+Br2=MgBr2(水溶液中);(此外,其中亦有Mg与H 、Mg与HBrO的反应);5.-1价的碘(氢碘酸及碘化物) 变色;6.NaOH等强碱:Br2+2OH‾==Br‾+BrO‾+H2O;7.Na2CO3等盐:Br2+H2O==HBr+HbrO;2HBr+Na2CO3==2NaBr+CO2↑+H2O;HBrO+Na2CO3==NaBrO+NaHCO3;8.AgNO3
32:能使酸性高锰酸钾溶液褪色的物质
(一)有机1.不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);2.苯的同系物;※3.不饱和烃的衍生物(烯醇、烯醛、烯酸、卤代烃、油酸、油酸盐、油酸酯等);4.含醛基的有机物(醛、甲酸、甲酸盐、甲酸某酯等);5.酚类;6.石油产品(裂解气、裂化气、裂化汽油等);7.煤产品(煤焦油);8.天然橡胶(聚异戊二烯)。
(二)无机1.氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物);2.亚铁盐及氢氧化亚铁;3.-2价硫的化合物(H2S、氢硫酸、硫化物);4.+4价硫的化合物(SO2、H2SO3及亚硫酸盐);5.双氧水(H2O2,其中氧为-1价)
33:能爆炸的物质
1.液氧炸药;2.黑火药(成分有硫、KNO3和木炭);3.NH4NO3;4.红磷与KClO3
5.TNT(雷汞作引爆剂);6.硝化甘油;7.火棉;8.氮化银(Ag3N)此外,某些混和气点燃或光照也会爆炸,其中应掌握:"点爆"的有:H2和O2、CO和O2、CH4和O2、C2H2和O2;"光爆"的有:H2和Cl2、CH4和Cl2无需点燃或光照,一经混和即会爆炸,所谓"混爆"的是H2和F2。另外,工厂与实验室中,面粉、镁粉等混和在空气中,也易引起爆炸,是一个很关键的危险源,应引起重视。
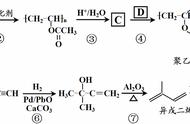
34:六种方法得乙醇
1.乙醇还原法:CH3CHO+H2→C2H5OH(条件: Ni△)
2.卤代烃水解法:C2H5X+H2O → C2H5OH+HX(条件:NaOH△)
3.某酸乙酯水解法:RCOOC2H5+H2O → RCOOH+C2H5OH(条件:NaOH)
4.乙醇钠水角法:C2H5ONa+H2O → C2H5OH+NaOH
5.乙烯水化法:CH2=CH2+H2O → C2H5OH(条件:H2SO4或H3PO4加热、加压)
分子中引入羟基的有机反应类型1.取代(水解):卤代烃、酯、酚钠、醇钠、羧酸钠;2.加成:烯烃水化、醛 H2;3.氧化:醛氧化;4.还原:醛 H
35:官能团的主要化学性质
碳碳双键,碳碳三键 易发生氧化反应、加成反应、聚合反应
-OH (醇) 与Na反应、催化氧化生成醛、分子内脱水生成烯、与羧酸生成酯。
-OH (酚) (弱酸性)与NaOH溶液发生中和反应、取代反应、显色反应。
醛基 与H2加成生成醇,被O2、银氨溶液、新制Cu(OH)2悬浊液氧化成羧酸。
羧基 具有酸的通性、与醇发生酯化反应。
酯基 酸性条件下水解不彻底,生成羧酸和醇;碱性条件下水解彻底,生成羧酸盐和醇。
36:常见有机物之间的转化关系

37:化学实验中应掌握的几个分数
1.试管里盛放液体的量不超过试管容积的1/3
2.配制王水时,应使浓HNO3中的溶质的物质的量占浓HCl中的1/3
3.无水乙醇与浓H2SO4反应制乙烯时,加入的乙醇的量占浓H2SO4的量的1/3
4.给试管里的固体加热时,铁夹应夹在离试管口的1/3至1/4处;
5.蒸发皿中盛装液体的量不超过容积的2/3;
6.酒精灯里装入酒精的量不超过容积的2/3,也不少于1/4。
38:常用化学仪器是否可以加热的问题
(一)可加热的:可直接加热的:坩埚,蒸发皿,试管,燃烧匙,可间接加热的:烧杯,烧瓶,锥形瓶等;
(二)不可加热的:表面皿、容量瓶、启普发生器、量筒、漏斗、药匙、滴定管等大多数仪器。
39:关于化学仪器的"零刻度"
有零刻度的是:1.滴定管——零刻度在上面;2.温度计——零刻度在中间;3.托盘天平——零刻度在刻度尺的最左边。 此外,量筒是无零刻度的,温度计的零刻度因各类不同而不能确定。容量瓶、移液管等只有一个标示容积的刻线,也不是零刻度。
40:不宜长期暴露于空气中的物质
1.由于空气中CO2的作用:生石灰、NaOH、Ca(OH)2溶液、Ba(OH)2溶液、NaAlO2溶液、水玻璃、碱石灰、漂白粉、苯酚钠溶液、Na2O、Na2O2;
2.由于空气中H2O的作用:浓H2SO4、P2O5、硅胶、CaCl2、碱石灰等干燥剂、浓H3PO4、无水硫酸铜、CaC2、面碱、NaOH固体、生石灰;
3.由于空气中O2的氧化作用:钠、钾、白磷和红磷、NO、天然橡胶、苯酚、-2价硫(氢硫酸或硫化物水溶液)、+4价硫(SO2水溶液或亚硫酸盐)、亚铁盐溶液、Fe(OH)2。
4.由于挥发或自身分解作用:AgNO3、浓HNO3、H2O2、液溴、浓氨水、浓HCl、Cu(OH)2。
41:实验室中意外事故的急救
1.玻璃割伤 除去伤口的碎片,用医用双氧水擦洗,用纱布包扎。其他"机械类"创伤也类似于此,不要用手触摸伤口或用水洗涤伤口。
2.烫伤 涂抹苦味酸溶液、烫伤膏或万花油,不可用水冲洗;特别严重的地方不能涂油脂类物,可用纯净碳酸氢钠,上面覆以干净的纱布。
3.浓酸撒落 撒在桌面上,先用NaHCO3溶液中和,然后用水冲洗,再用抹布擦净;沾在皮肤上,不能用水冲洗,应先用布拭去,然后用水冲洗,最后涂上3%-5%的NaHCO3溶液。
4.浓碱撒落 撒在桌面上,先用稀醋酸中和,然后用水冲洗,用抹布擦干净;沾在皮肤上,用较多的水冲洗,再涂上硼酸。
5.眼睛的化学灼伤 凡是溶于水的化学药品进入眼睛,最好立刻用水流洗涤之后,如是碱灼伤则再用20%硼酸溶液淋洗;若是酸灼伤,则用3%NaHCO3溶液淋洗。
42:常用的灭火器

43:三处涉及到"棉花团"的化学实验
1.加热法制氧气:"棉花团"在大试管口处,防止K MnO4粉末从导管喷出;
2.实验室制NH3 "棉花团"在收集NH3的试管口处,防止NH3与空气对流,确保收集纯净;
3.实验室制C2H2 "棉花团"在反应试管口处,防止生成的泡沫涌入导管。
44:三处涉及到碎瓷片的化学实验
乙醇与浓硫酸混和制乙烯;石油的蒸馏;乙酸乙酯的制装置。
※所加碎瓷片的作用:防暴沸(或避免混和液在受热时剧烈跳动)。
45:三处涉及到温度计的化学实验
1.实验室制乙烯:温度计的水银球插在乙醇与浓H2SO4的混和液的液面以下,用以测定混和液的温度,控制温度使温度迅速升高到170℃;
2.实验室蒸馏石油:温度计的水银球插在蒸馏烧瓶的支管口的略下部位,用以测定蒸汽的温度。
3.苯的硝化反应实验:温度计的水银球插在水浴中,用以测定水浴的温度,控制水浴温度在50~60℃。
此外,KNO3的溶解度的测定的实验中,温度计的水银球插在试管内KNO3溶液中用以测定溶液温度保持相对稳定,不过此实验为教材的选做实验,可一般了解。
46:需水浴加热的实验 苯的硝化反应:50~60℃的水浴;所有的银镜反应:温水浴;
酚醛树脂的制取:沸水浴(100℃);乙酸乙酯的水解:70~80℃水浴;
47:化学方法洗涤试管 I2(酒精);Cu、银镜(稀HNO3);Fe(OH)3(稀HCl);CaCO3(稀HCl);苯酚(NaOH或酒精);硫(CS2);MnO2(浓HCl(加热));FeS(稀H2SO4);油脂(NaOH)
48: 常见物质的俗名与别名
小苏打、重碱; 苏打、面碱; 口碱、晶碱; 苛性钠、火碱、烧碱
芒硝、皮硝、朴硝; 无水芒硝、元明粉; 钠硝石、智利硝石; 食盐
草碱、钾碱; 苛性钾; 硝石、钾硝石、火硝、土硝; 碳铵
硝铵; 硫铵、肥田粉; 菱镁矿; 泻盐、苦盐
卤盐; 生石灰; 熟石灰、消石灰; 漂白粉
大理石、石灰石、白垩、方解; 石萤石、氟石; 生石膏、石膏
熟石膏、烧石膏; 无水石膏、硬石膏; 普钙 ; 重钙
电石; 钡白、钡餐 ; 锌钡白、立德粉; 重晶石; 银粉
矾土; 刚玉、红宝石、蓝宝石; 明矾; 冰晶石
石英、水晶、玛瑙; 硅胶; 泡花碱、水玻璃; 金刚砂; 赤铜矿
辉铜矿; 胆矾、蓝矾; 铜绿、孔雀石; 铁丹、铁红、赭石、赤铁矿
铁黄、铁锈; 铁黑、磁铁矿; 褐铁矿; 菱铁矿; 黄铁矿、硫铁矿、愚人金
绿矾、黑矾; 方铅矿; 砒霜、白砒; 大苏打、海波; 皓矾、锌矾
菱锌矿; 朱砂、辰砂、丹砂; 雷汞; 波尔多液; 沼气、坑气、天然气
电石气; 福尔马林; 蚁酸; 电木、酚醛树脂; 石炭酸
苦味酸; TNT; 安息香酸; 尿素; 氟里昂; 卫生球; 蚁醛; 氯仿
49:化学平衡状态有哪些标志?