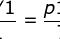1.理想气体状态方程
(1)理想气体:在任何温度、任何压强下都遵从气体实验定律的气体。
①理想气体是一种经科学的抽象而建立的理想化模型,实际上不存在。
②理想气体忽略分子大小和分子间相互作用力,也不计气体分子与器壁碰撞的动能损失。所以理想气体的内能取决于温度,与体积无关。
③实际气体特别是那些不易液化的气体在压强不太大(相对大气压强)、温度不太低(相对室温)时都可当成理想气体来处理。
(2)一定质量的理想气体的状态方程:

(C是常量,与气体的质量、种类有关)。
2.气体实验定律的微观解释
(1)玻意耳定律的微观解释
一定质量的某种理想气体,温度保持不变时,分子的平均动能是一定的。在这种情况下,体积减小时,分子的数密度增大,单位时间内、单位面积上碰撞器壁的分子数就多,气体的压强就增大。
(2)盖—吕萨克定律的微观解释
一定质量的某种理想气体,温度升高时,分子的平均动能增大;只有气体的体积同时增大,使分子的数密度减小,才能保持压强不变。
(3)查理定律的微观解释
一定质量的某种理想气体,体积保持不变时,分子的数密度保持不变。在这种情况下,温度升高时,分子的平均动能增大,气体的压强就增大。