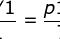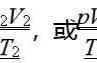理想气体的状态方程也是北京高考物理真题中几乎每年都会考到的考点,考查深度并不深,但是需要大家要彻底掌握,做到不失分,现在把理想气体的状态方程相关知识点介绍如下。
我们先来定义下什么样的气体是理想气体?
理想气体要满足三个方面的要求:
1、气体分子的分子大小可以忽略不计,类似力学中我们学到的质点,其大小也是可以忽略的;
2、气体分子之间的作用力可以忽略不计,也可以说气体分子势能为零;
3、气体分子与器壁碰撞时没有动能损失;
满足以上条件的气体,我们称之为理想气体。
理想气体是一种理想化的物理模型,正如力学中的质点,电学中的点电荷一样,都是理想化的物理模型。虽然理想化的物理模型在现实中不存在,但是它们能很好地帮助我们关注主要问题或者主要矛盾,减少非主要因素的影响,更加有利于我们对于物理问题的研究,所以理想化的模型思维能力对于我们的学习和研究都是非常重要的。
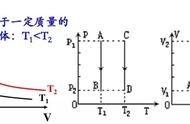
理想气体的状态方程描述的是:一定质量的理想气体,从一个状态变到另一个状态时,虽然其温度,压强以及体积都可能变化,但是压强P与体积V的乘积与温度T的比值保持不变。也就是:
其中,C就是那个不变的比值。
理想气体的状态方程是由气体等温变化的玻意耳定律,气体等压变化的盖-吕萨克定律,气体等容变化的查理定律共同组成的。我们把三个定律合起来后,就是理想气体的状态方程。
我们也来介绍下气体等温变化的玻意耳定律,气体等压变化的盖-吕萨克定律,气体等容变化的查理定律。
先来看下气体的等温变化的玻意耳定律。
一定质量的气体,在温度不变的情况下,压强P与体积V成反比,即:
PV=C,或者,P1V1=P2V2
其微观解释为:
一定质量的理想气体,在温度保持不变时,气体分子的平均动能是不变的,那么,随着气体的体积减小,那么,单位体积内的分子数就增多,那么,单位面积上碰撞器壁的分子数就变多,气体的压强就变大,反之,气体的体积变大,那么,单位体积内的分子数就减少,那么,单位面积上碰撞器壁的分子数就变少,气体的压强就变小,这就是玻意耳定律的微观解释。
接下来我们来看下气体的等压变化的盖-吕萨克定律。
一定质量的气体,在压强不变的情况下,气体的体积V与温度T成正比,即:
V/T=C,或者,V1/T1=V2/T2
其微观解释为:
一定质量的理想气体,当温度升高时,气体分子的平均动能增大,只有当气体的体积同时变大时,气体的压强才可能保持不变,反之,当温度降低时,气体分子的平均动能减小,只有当气体的体积同时变小,气体的压强才可能保持不变,这就是盖-吕萨克定律的微观解释。
最后,我们来看下气体等容变化的查理定律。
一定质量的气体,在体积不变的情况下,压强P与温度T成正比,即:
P/T=C,或者P1/T1=P2/T2
其微观解释为:
一定质量的理想气体,当体积不变时,气体的分子密度不变,当温度升高时,气体分子的平均动能变大,气体的压强就增大,反之,当温度降低时,气体分子的平均动能变小,气体的压强就变小,这就是查理定律的微观解释。
以上就是关于理想气体的状态方程的相关内容的介绍,供大家学习和参考。
,