决定物质氧化性、还原性及其强弱的因素
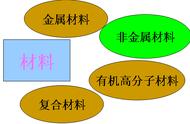
1、元素的金属性与非金属性
(1)金属:
①单质有且只有还原性,且金属性越强,单质的还原性越强。
②金属阳离子有(注:不是只有)氧化性,且金属性越强,金属阳离子的氧化性越弱。
即:金属性:Mg > Al > Zn >Fe >Sn > (H) > Cu >Hg >Ag
还原性:Mg > Al > Zn >Fe >Sn > (H2) >Cu >Hg >Ag >Fe2+
氧化性:Mg2+<Al3+<Zn2+<Fe2+<Sn2+ <H+<Cu2+<Hg2+<Ag+<Fe3+
(2)非金属:
①单质有(注:不是只有)氧化性,且非金属性越强,单质的氧化性越强。
②非金属的简单阴离子有且只有还原性,且非金属性越强,简单阴离子的还原性越弱。
③形成简单氢化物有还原性,且非金属性越强,氢化物还原性越弱。
即:非金属性:F >O > Cl > N > Br >I > S
氧化性:F2 >O2 > Cl2 > N2 > Br2 > I2 > S
还原性:F-(HF)<O2-(H2O)<Cl-(HCl)<N3-(NH3)<Br-(HBr)<I-(HI)<S2-(H2S)
④S、C、H2等非金属单质主要表现还原性。
2、物质的稳定性——物质越稳定,化学活泼性越弱,有氧化性氧化性越弱;有还原性还原性越弱。
①非金属元素的气态氢化物越稳定,还原性越弱
即:非金属性: F > O > N >C Cl >S >P >Si
稳定性:HF> H2O >NH3>CH4 HCl >H2S >PH3 >SiH4
还原性:HF<H2O<NH3<CH4 HCl<H2S<PH3<SiH4
②KMnO4、KClO3、HClO(新制氯水)及其盐、HNO3及其盐稳定性较弱——实验室必需放入棕色试剂瓶中,都具有强的氧化性。
③虽然N的非金属性较强,但由于N2分子结构很稳定,其氧化性、还原性都不强。
3、元素的化合价
①元素化合价处在最低价(如金属单质和非金属简单阴离子等)时,有且只有还原性。②元素化合价处在最高价((如Na+、H+、CO2中 4价C、SO42-中 6价S、NO3-中 5
价N等)时,有且只有氧化性。
4、溶液的酸碱性
①酸性时,许多含氧酸根[如MnO4n-、Cr2O72-、ClOn-、NO3-、SO42-(浓酸)等]有强氧化性,且酸性越强,氧化性越强。
②浓酸性时,Cl-才有强还原性(可氧化成Cl2)
③碱性时,X2(Cl2、Br2、I2)、S等发生歧化反应(电子转移发生在同一分子内的同一价态的同一原子间的反应)——同时有氧化性和还原性;酸性时,歧化产物发生反歧化反应。
如:Cl2 H2O= HCl HClO(不完全反应)
Cl2 2NaOH= NaCl NaClO H2O
NaCl NaClO H2SO4(浓)= Cl2↑ Na2SO4 H2O
3S 6NaOH= 2Na2S Na2SO3 3H2O
2Na2S Na2SO3 3H2SO4=3S↓ 3Na2SO4 3H2O
2H2S SO2=3S↓ 2H2O(相当于S2-、SO32-在酸性条件下的反应)
5、反应的温度——温度越高,有氧化性氧化性越强;有还原性还原性越强。
例题1、对于Cu2+,I-,Cl-,H+,Ag+,Fe2+,S2-等微粒,其中:
能被氧化的有:I-,Cl-,Fe2+,S2-;能被还原的有:Cu2+,H+,Ag+,Fe2+;
氧化性最强的是:Ag+;还原性最强的是:S2-。
例题2、试分析盐酸溶液中有哪些溶质离子;并由此分析盐酸具有中哪些化学性质(指酸性,氧化性,还原性);各以一个化学方程式来说明。
溶质离子有:H+,Cl-。 还原性:MnO2 4HCl(浓)== MnCl2 Cl2↑ 2H2O
酸性:NaOH HCl= NaCl H2O 氧化性:Zn 2HCl= ZnCl2 H2↑(也是酸性)
例题3、下列叙述正确的是( ) 答案:b.
a.非金属单质只能作氧化剂 b.金属单质只能作还原剂
c.阳离子只能作氧化剂 d.阴离子只能作还原剂
例题4、下列离子或原子中,不能表现氧化性的是( ),不能表现还原性的是( )
a.Na b.H c.S d.Na e.Ag f.Cu 答案:a./b.d.e.
例题5、比较下列各点:
(1)还原性:①Na、Mg、Al、Si: Na>Mg>Al>Si
②F-、Cl-、Br-、I-、S2-: F-<Cl-<Br-<I-<S2-
③H2、Cu、Hg、Ag: H2>Cu>Hg>Ag
④H2O、H2S、H2Se: H2O<H2S<H2Se
(2)氧化性:①Na+、Mg2+、Al3+、H+、Cu2+、Hg2+、Ag+: 依次增强
②F2、Cl2、Br2、I2、S、Fe2+、Fe3+: F2>Cl2>Br2>Fe3+>I2>S>Fe2+
,