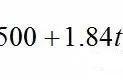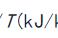一、热力系统
1、(热力)系统:
系统:通常选取一定的工质或空间作为研究对象,称之为热力系统。
2、外界:与体系发生质、能交换的物系。
3、边界:系统与外界的分界面(线)。
边界可实可虚,可定可动。
二、系统的分类
根据系统和外界之间物质、能量的交换情况分:
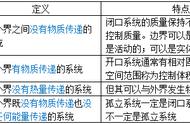
1、闭口系统(控制质量):和外界没有物质交换。
2、开口系统(控制容积、控制体)和外界有物质交换。
3、绝热系统:和外界间没有热量交换。
4、 孤立系统:和外界既无能量交换又无物质交换。

三、平衡状态
(一)定义:无外界影响(重力场除外)的条件下,系统保持状态参数不随时间而改变的状态。
1、热平衡:在无外界作用的条件下,系统内部、系统与外界之间无温差。
2、力平衡:在无外界作用的条件下,系统内部、系统与外界之间无压差。
3、化学平衡:在无外界作用的条件下,系统内部、系统与外界之间无化学势差。
平衡的充要条件:系统同时达到热平衡、力平衡、化学平衡。
(二)平衡状态的特点:
1、在不受外界影响下,平衡不会自发的破坏;
2、处于不平衡的系统,在不受外界影响时,会自发的趋于平衡;
3、单相工质处于平衡状态时,在忽略重力的影响下,其内部性质均匀一致。
4、平衡必稳定,稳定未必平衡,平衡可以不均匀。
★对于气液两相并存的热力平衡系统,气相和液相密度不同,所以整个系统不是均匀的。
四、状态参数
状态确定,状态参数的数值也确定,反之亦然。非平衡状态系统内部存在不平衡势,因此不能用状态参数来描写。
(一) 状态参数分类:
1、基本状态参数:压力P、比体积v、温度T(可以直接测量)
导出状态参数:内能U、焓H、熵S
2、强度参数:参数与系统质量无关,且不可相加。如:P、T
广延参数:参数与系统质量成正比,且可相加。如:m、V、U、H、S
(二) 基本状态参数
1、 温度
摄氏温度 t(℃)与热力学温度T(K)
关系:t=T-273.15
2、压力(绝对压力)p Pa、MPa
(压强)单位面积上的垂直作用力。
绝对压力p;表压力pe;真空度pv;环境压力pb。

绝对压力的值不变,表压力或真空度会随着环境压力的变化而变化。
常用单位:
巴 1 bar =100000 Pa;
标准大气压 1 atm =101325 Pa;
工程大气压 1 at = 98066.5 Pa; 10米水柱的压力
毫米汞柱 1 mmHg =133.3224 Pa;
毫米水柱 1 mmH2O=9.80665 Pa。
注意:只有绝对压力 p 才是状态参数,才能直接进行热力计算。
3、比体积及密度 v = V/m =1/ρ m3/kg
(三)简单可压缩系统(只有热量交换和体积变化功量的交换),只需两个独立的参数(如p、v,p、T 或v、T)便可确定它的平衡状态。
(四)状态参数坐标图
①一简单可压缩系只需两个独立参数就可以确定其平衡状态
②图上每一点都代表一个平衡状态。
③ 不平衡态无法在坐标图上表示
五、功量
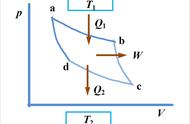
容积变化功的计算:
功是过程量,可以用p-v图上过程线与v轴包围的面积表示
功的符号约定:系统对外作功(膨胀)为“ ”,W>0
外界对系统作功(压缩)为“-”,W<0
功和功率的单位:J或KJ,W或KW
示功图:

六、热量
定义:仅仅由于温差而通过边界传递的能量。
计算式