像原电池的部分,定义上不就是自发滴氧还反应吗? 电解池的部分,定义就是非自发的氧还反应。
1.简单的原电池:一般就是负极 电解液的反应(Mg-Al-NaOH\Cu-Zn-H2SO4\Cu-Fe-浓HNO3)
Mg-Al-NaOH,自发的可不就是Al和NaOH的那个2223方程嘛!Al为负极。
Cu-Fe-浓HNO3,这个本来Fe老哥想先跟浓HNO3来一发的,但是...Fe后继乏力,因为钝化了,所以直接就理解为是Cu和浓硝酸的氧化还原反应,Cu为负极。
2.复杂原电池(一次电池/二次电池/新型电池)
一般就是负极和正极的反应(负极为金属,正极一般为金属氧化物,或者有高价元素的物质)
锌锰干电池:Zn(负极)—MnO2(正极)—KOH(电解液)
铅蓄电池:Pb(负极)—PbO2(正极)—H2SO4(电解液)
锂电池:LI(负极)—LiMnO4(正极)—带Li离子化合物(如Li2SO4)
想:为啥负极为金属咧?正极是金属氧化物?
负极作还原剂只能升价,金属单质可不就是只能升价嘛?正极就是氧化剂,氧多的金属元素价态就呼呼呼往上走,氧化性就强。
比如锌锰干电池:可不就是Zn和MnO2扭打在了一起吗,锌作为负极被氧化,正极MnO2作氧化剂被还原。
Zn+2MnO2+2H2O→2MnO(OH)+Zn(OH)2
关于Li电池(高考考了N次了!非常重要)
无论什么时候Li都只能作负极(负极还会出现的幺蛾子XLi,LixC6)
正极只要是高价的金属氧化物成,有强氧化性就成,高考常考的正极。

分别变化起氧化性的是:Co( 3有强化性) Mn Fe Fe
二、基础好的同学(做好大题和分类)

(一)工业流程
工业流程考什么?
1.金属非金属的性质(氧化性还原性、与酸碱的反应)
2.怎么除沉淀(加入能反应的离子溶液生成沉淀出去,调节PH利用水解出去),哪些东西是沉淀(沉淀的那几句口诀)
3.氧化还原的方程式的考察
①加入的氧化剂能与溶液哪些还原性离子反应
②加入的还原剂,能与溶液中的哪些氧化性离子反应
4.电化学。涉及到最后要得到的金属单质还是金属氧化物,得升价得降价,要写电极方程式。电解池:氧化阳极、还原阴极
5.水解,调节PH,调节到多少能把溶液中的金属阳离子出去,除完全(浓度小于等于10的负五次方)KSP,如何判断沉淀完全。
6.实验操作(过滤,洗涤,干燥)过滤需要哪些玻璃仪器,操作如何(洗涤的操作是怎么样的、检验沉淀是否洗涤干净)
7.工业流程步骤
①原料的预处理
②酸浸/碱浸→过滤
③加物质除杂→过滤
④调PH除杂→过滤
⑤得到纯产品
⑥蒸发浓缩冷却结晶,过滤洗涤干燥
(二)化学平衡
大家一定要清楚四个要素,浓度,温度,压强,催化剂对反应平衡速率的影响,然后对平衡的影响,改变这些条件然后对c-t图像的影响(高考大题常考)。
常考点:1.化学平衡速率的影响
2. 平衡移动的判断(①勒夏特列②V正V逆③QC与K)
3. 3.V-T图像
4.C-T图像
5.平衡的判断
四类题型(穿插3段式计算,转化率)
1.C-T图像(判断改变的条件)
2.恒压通入反应物生成物判断移动→算体积
3.恒容通反应物生成物判断移动(QC=K? )给速率,做计算
4.气体分压来计算平衡移动,或者计算气体分压。
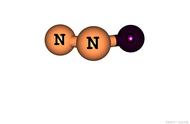
氧还配平方法:
陌生氧化还原的配平法 :

怎么算是学好了化学:能够将复杂的东西,简单化(体系化)将记忆量减小
以下是小编想教给大家方程式的配平方法