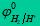电极电势 electrode potential

电极与溶液接触时所产生的电势差。衡量电极反应趋势的参数。又称电极电位,简称电极势。因电极上所起的电化学反应都是氧化还原反应,电极电势又称氧化还原电势。
当一个金属电极浸在该金属的一种盐类溶液中时,金属中的原子有离开晶格、转变为金属正离子而进入溶液的倾向,溶液中的金属离子也有在金属电极的表面还原为原子而沉积的趋势。这样电极表面因聚积电子而带负电,靠近电极表面的溶液则因聚积着金属离子而带正电;反之亦然。因此在电极和溶液之间存在着一定的电势差。
不同的金属在其不同浓度的盐溶液中的电势差也各不相同。没有可能也没有必要去测定各种物质电极电势的绝对值,而是将1大气压(帕)氢气所饱和的铂片与浓度为1摩/升的氢离子溶液之间的电势差规定为0伏(该电极称标准氢电极),即规定在上述条件时下列还原反应的平衡电势等于0伏:
(1)
然后将其他金属与其盐溶液所构成的电极直接或间接和标准氢电极相连接,组成化学原电池,测定电池的电动势,即得该金属电极电势与氢电极电势之间的相对值。例如,将M金属与离子溶液所构成的电极:
(2)
与标准氢电极相连接组成电池进行测定,实验测得的电池电动势即定为电极的电势。当在1大气压下和溶液中离子浓度为1摩/升时,即在标准状态下这个电池的电势值便是电极的标准电势。一般是将电极反应与成式(2)那样的还原反应的形式,相应的电极电势就称为标准还原电势。那些比容易还原的物质的还原电势具有正值,而那些比难以还原的物质的还原电势便具有负值。
除金属以外,其他物质的还原电势也是参照标准氢电极电势为0伏而求得的。它们的标准还原电势是指参加反应的氧化态和还原态物质的浓度都处于标准状态时的平衡电势,对于非标准状态下的还原电势,可以用能斯特公式表示:
式中是标准还原电势,R为气体常数,T为绝对温度,n为该还原反应中的电子转移数,F为法拉第常数,、分别为氧化态物质、还原态物质的活度。当反应中物质的浓度均等于1摩/升时,,即平衡电势为标准还原电势。

各种物质在酸性溶液中的标准还原电势见表。如果把表中的半反应与成氧化反应的形式,则电势就变成标准氧化电势,其数值与原来的还原电势相同,只是符号相反。
一种物质的还原电势愈大,表明它愈容易还原,即该物质愈容易从其他物质获取电子,从而将其他物质氧化。表中最下面所列一些半反应中,左侧的物质都是一些强氧化剂,如卤素、氯酸盐、高锰酸盐、过氧化氢等;而最上面所列那些半反应中右侧的物质,则是一些强还原剂,如碱金属、碱土金属、铝等。
摘自:《中国大百科全书(第2版)》第5册,中国大百科全书出版社,2009年
,