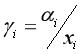碳酸钙在20℃的溶解度是0.0065克,而碳酸氢钙在20℃的溶解度是16.60克。
为什么相差这样大呢?
影响物质溶解度的因素很多。离子化合物的溶解度主要应考虑化合物的阴、阳离子的半径的大小,离子电荷的多少以及水合作用等因素。
不同类的盐决定其溶解度大小主要因素也不同。
正盐和酸式盐比较,一般酸式盐酸根离子的半径小于正盐酸根离子的半径,离子电荷也同样前者少于后者。
离子半径和电荷的变化会引起化合物中键极性的变化。譬如离子间的相互极化作用,在极化过程中通常最容易变形的离子是体积的大的阴离子。由于极化作用使离子键向共价键过渡,而共价型的无机物晶体在水中是不溶的。
CO2-比HCO3-半径大更容易变形,极化作用较大。因此碳酸钙比碳酸氢钙溶解度小。