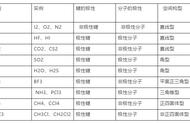
H2O是两对未成键的孤对电子和2个H-O共价键杂化而成的
3.3.1.4分子轨道理论

分子轨道理论可以简单看成原子轨道的扩展版

氢气的分子轨道
成键之后,一个氢气分子的能量比两个氢原子能量变低了,也就是说氢气分子比氢原子更稳定。这里要指出一点:化学上说的稳定状态,通常指的是能量更低的状态。
配位键(特殊的共价键):
配位化合物中心原子与配体之间形成的共价键叫做配位键,其共用电子对由配体提供
配位理论是特殊的共价键理论,除了共价键的特点外,他还有自己独特的理论:配体场理论
螯合物:五元环和六元环最稳定
3.3.1.5化学键的离子性和共价性
典型的离子键或典型的非极性共价键组成的化合物很少,大多数物质的化学键都有离子键和共价键的双重性质

氢气的电子随时都在运动
同种元素的不同价态的离子,正离子价态越高,吸引负离子的电子云的能力越强,使负离子的电子云发生变形,更接近于共价键,熔点比较:FeCl3<FeCl2
含高价态的正离子的化合物,偏向于是分子晶体;含低价态正离子的化合物,偏向于离子晶体。
下一节讲分子间作用力
,