本文来自*X-MOLNews
芳基乙胺骨架广泛存在于多巴胺、5-羟色胺及许多阿片类受体药物分子中,可用于缓解疼痛和治疗神经行为障碍。与此同时,治疗阿片类药物成瘾的一线药物(如纳曲酮、丁丙诺啡)中也包含芳基乙胺结构。发展高效构建芳基乙胺结构的方法对于新药的研发具有十分重要的意义。传统的合成方法需借助多步同系链增长以及还原胺化反应来实现,如果能通过一次操作引入两种化学键(C-C键和C-N键),便可以大大简化合成芳基乙胺类药物的过程,为相关药物的研发带来便利。
烯烃的氨基芳基化有望解决这一问题。随着过渡金属催化反应的发展,人们陆续报道了铜、钯、镍和金等金属催化剂参与的烯烃立体选择性氨基芳基化反应,烯烃在过渡金属催化剂的作用下发生立体选择性氨基化环化,进而发生芳基化。反应中如何抑制质子解及β-H消除等副反应途径成为烯烃氨基芳基化的关键。酰胺、胺比烯烃的亲核性强,因此需要升高反应的温度促进配体解离并与反应物结合。反应常需要借助导向基团,并局限于分子内的过程,由此将产物限定为包含吡咯烷和哌啶结构的分子。随后分子间的氨基芳基化和碳胺化反应得以实现,2017年,林振阳和刘国生教授等人以具有氧化活性的N-氟-N-甲基苯磺酰胺作为胺源,实现了Cu(I)催化分子间的乙烯基芳香烃的对映选择性氨基芳基化。2015年,Tomislav Rovis等人实现了Ru(III)催化N-烯氧基邻苯二甲酰亚胺对烯烃的分子间碳胺化反应。除此之外,Meerwein氨基芳基化反应也可用于该类化合物的合成,反应遵循马氏规则选择性,但缺乏立体选择性控制。随后人们又发展了光催化反马氏规则选择性的烯烃氢胺化及碳氨化反应,体系中产生的氨基及酰胺基阳离子自由基可对烯烃进行加成,进而形成β-氨基自由基,被氢原子转移试剂捕获。但如何抑制烯烃加成过程中伴随的烯丙基攫氢竞争反应一直是氮自由基化学面临的挑战,反应常需加入过量的烯烃或设计分子内的氨基环化过程。David Nicewicz等人利用烯烃的单电子氧化策略,将烯烃转化为更为亲电的物种,有效降低了试剂的用量。

Corey Stephenson教授。图片来源:University of Michigan
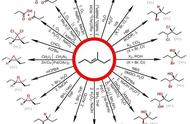
近期,美国密歇根大学的Corey R. J. Stephenson教授团队受到自由基Smiles-Truce重排反应的启发,设计了芳基磺酰胺作为氨基芳基化双官能化试剂,在光催化下富电子烯烃发生氨基芳基化反应,由此高效得到一系列2,2-二芳基乙胺。该反应具有优异的反马氏规则区域选择性与非对映选择性,且在室温下即可进行,具有良好的官能团兼容性。相关工作发表在Science上(图1)。

图1. 合成芳基乙胺的策略。图片来源:Science
尽管人们已发展了很多自由基Smiles-Truce重排反应,但大多数需要在加入还原剂的条件下进行,与此同时产生化学计量的副产物,底物的适用范围也十分有限。作者提出了图2A所示的反应机理,首先与激发态的催化剂*IrIII 氧化烯烃I,得到中间态I● ,芳基磺酰胺II对其进行亲核加成并去质子化得到β-氨基烷基自由基中间体III,该中间态接着进行本位的区域选择性环化,得到IV物种,IV进行脱硫反应可通过两种路径进行,其一是直接脱掉一分子二氧化硫得到氮自由基V,其二是进行芳基碳-硫键的均裂反应得到硫自由基VI,中间体V和VI进行单电子转移反应,V质子化、VI脱砜质子化得到最终的烯烃氨基芳基化产物。作者接着选择对甲氧基苯乙烯1和1-萘基磺酰胺2作为模板底物对反应条件进行了考察,在光催化剂3(Ir(dF(CF3ppy)2)(5,5'-CF3-bpy)]PF6)的作用下,以30 mol%的PhCOOK作为碱,反应在23 ℃下蓝光LED灯照射16 h,以41%的产率得到氨基芳基化产物4(图2)。

图2. 反应的机理和反应的初步尝试。图片来源:Science
在最佳条件下,作者对底物的适用范围进行了考察,主要考察了对甲氧基苯乙烯类烯烃末端R1取代基和芳基磺酰胺氮取代基R、芳基取代基对反应结果的影响。随着氮取代基R的位阻增大、吸电子能力增强,反应的收率也随之降低,甚至不反应,产物4-10的产率就是很明显的对比。作者接着固定R为乙酰基取代基,R1甲基取代基,考察芳基磺酰胺中的芳基取代基,芳基为杂环或芳基烯烃时,反应都能顺利地获得目标产物,产率最高可达到89%。当R1为官能化的取代基时,反应也能以中等的产物得到产物21和22。作者又考察了环状烯烃的适用性,仍可以顺利得到环状产物,但是产率出现了不同程度的下降。产物15和23的相对和绝对构型通过X射线单晶衍射得以确定(图3)。

图3. 底物适用范围的考察。图片来源:Science
作者接着设计了几个实验来研究高效转化和高非对映选择性的成因,假设顺式和反式的非环状烯烃参与反应都得到同样反式的氨基芳基化产物,这一假设是基于图2反应机理中中间体III发生键旋转的速度要快于环化的速率。值得注意的是使用顺式的茴香烯作为底物时,得到的产物9还是与反式的茴香烯得到的产物具有一样的构型,产率也基本相同,非对映异构体9'没有观察到。核磁分析表明,顺式的茴香烯参与反应时,反应过程中有反式的茴香烯形成。基于这一结果,作者研究了在光照下这两种异构体的异构化速率,顺式构型烯烃的初始异构化速率要明显快于反式的烯烃,并快于烯烃消耗的速率。作者根据以上实验数据,推断产物的非对映选择性可能来源于如下的某一个因素:(1)反式茴香烯自由基阳离子具有动力学优势构型,随后发生氨基芳基化;(2)自由基中间体III倾向于在环化前采取对甲氧基苯基与甲基反叠的热力学优势构象。除此之外,还有可能是反式的茴香烯阳离子自由基与2的反应速率比顺式的快。

图4. 反应机理的研究。图片来源:Science
——总结——
Corey R. J. Stephenson教授基于Smiles-Truce重排反应与自由基阳离子化学,报道了光催化芳基磺酰胺作为双官能化试剂的烯烃分子间氨基芳基化反应,、由此高效合成了一系列芳基乙胺类产物,反应具有优异的非对映选择性。与传统的自由基Smiles-Truce重排反应相比,该方法不会产生多余的副产物,且底物的适用范围广泛,为加速芳基乙胺类药物分子的研发及改性提供了重要的手段。
原文
Arylsulfonylacetamides as bifunctional reagents for alkene aminoarylation
Science, 2018, 361, 1369, DOI: 10.1126/science.aat2117
导师介绍
Corey R. J. Stephenson
http://www.x-mol.com/university/faculty/1704
,