络合物(配位化合物)是一类具有化学结构的物质,其中中心金属原子被一组原子团或非金属原子团包围,这些原子团或非金属原子团被称为配体,通过化学键与中心金属原子连接。如血红蛋白、叶绿素、维生素B12、色素和着色剂以及催化剂等在制备有机物质中所包含的物质提供配位化合物。
络合物是路易斯酸碱反应的产物,其中中性分子或阴离子(称为配体)通过配位共价键与中心金属原子(或离子)结合。
配体是路易斯碱-它们包含至少一对电子,以捐赠给金属原子/离子。配体也称为络合剂。
金属原子/离子是路易斯酸——它们可以接受来自路易斯碱的电子对。
在配体中,直接与金属原子/离子结合的原子称为给体原子。
配位共价键是一个原子(即施主原子)同时提供两个电子的共价键。这种类型的键不同于普通的共价键,普通共价键中每个原子提供一个电子。
如果配位化合物带净电荷,则称为化合物离子。
含有配位化合物的化合物称为络合物。
配位数是与中心金属原子/离子结合的施主原子数。
配位化合物的一个主要应用是用作改变化学反应速率的催化剂。例如,某些复杂金属催化剂在聚丙烯和聚乙烯生产中起着关键作用。此外,一类非常稳定的有机金属配位化合物为有机金属化学的发展提供了动力。有时,“三明治”构型描述了有机金属配位化合物,其中两个不饱和环烃分子,缺少一个或多个氢原子,与金属原子的两侧结合。这就形成了一个高度稳定的芳香体系。
配位化合物的结构Werner最初假设配位化合物的形成是由于中心原子除了具有生成价键或正价键的能力外,还具有生成配位键或二级键的能力。在20世纪20年代,随着所有共价键都是由原子间共享的电子对组成的概念的引入,用电子对对配位键的完整描述成为可能。这个想法主要是由美国物理化学家吉尔伯特·刘易斯提出的。在这个刘易斯的分子式中,当两个电子都由一个原子贡献时,类似于三氟化硼(BF3)与氨结合时形成的硼氮键,这种键称为配位键:
自然界中的配位化合物自然发生的配位化合物对生物体至关重要。金属配合物在生物系统中发挥着多种重要作用。几种酶,自然产生的催化剂,调节生物过程,是金属配合物(也称为金属酶)。例如,羧肽酶是消化过程中必不可少的一种水解酶,它含有锌离子,协调蛋白质中过多的氨基酸残基。另一种酶过氧化氢酶是过氧化氢分解的有效催化剂,它含有铁卟啉复合物。在这两种情况下,配位金属离子可能是催化活性位点。此外,血红蛋白含有铁卟啉复合物,其作为氧载体的作用与铁原子可逆协调氧分子的能力有关。其他生物必需的配位化合物如维生素B12,钴配合物与大环配体,和叶绿素(一种镁卟啉配合物)。
工业中的配位化合物配位化合物在化学和技术中的应用是多种多样的。几种配位化合物(如普鲁士蓝)的强烈而明亮的颜色使它们作为颜料和染料极具价值。一类重要的织物染料是含有大环配体的酞菁配合物(如酞菁铜),它与卟啉紧密相连。
许多重要的湿法冶金工艺都利用金属配合物。钴、铜和镍可以从它们的矿石中以胺与水氨的配合物的形式提取出来。胺配合物的溶解度和稳定性的差异在选择性沉淀过程中被利用,这带来了金属分离。通过与一氧化碳反应生成挥发性四羰基镍络合物,影响镍的提纯,该络合物可进行蒸馏和热分解得到纯金属沉淀。氰化物水溶液以极其稳定的双氰金酸盐(-1)配合物的形式,通常用于金与其矿石的分离。氰化物配合物也在电镀中得到应用。
配位化合物的特性由于某些配位化合物具有特殊的化学性质和特殊的化学性质,配位化合物的化学键和分子结构也得到了广泛的研究。配合物或一般类型的配位化合物,如它们有时被称为,是多样和广泛的。这类物质可以由电中性分子或带正电或带负电的物质(即离子)组成。
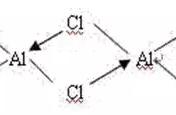
在几种具有中性分子的配位化合物中,六氟化铀(UF6)或氟化铀( 6)。化合物的结构式表明了原子在分子中的实际排列:
实线在上面给出的公式,这代表键之间的原子,描绘了四氟(F)的原子是连着一个铀原子(U)在一个平面, 用虚线所示, 而另外两个氟原子(也可以与铀原子相连)则分别位于平面的上方和下方。
络合物的例子
离子络合物的一些例子是作为六水镍(2 )离子, [Ni(H2O)6]2 的水合离子给出的。在这个结构中,线和符号用在上面,括号和“2 ”(2 )符号表示双正电荷被分配到单位作为一个整体。
,