1. 什么是大π键?
在多原子分子中,如有相互平行的p轨道,
它们连贯重叠在一起构成一个整体,p电子
在多个原子间运动形成π型化学键,这种
不局限在两个原子之间的π键称为离域π
键或共轭大π键。
2. 形成大π键的条件是什么?
1.这些原子都在同一平面上;
2.这些原子有相互平行的p轨道;
3.p轨道上的电子总数小于p轨道数
的2倍。
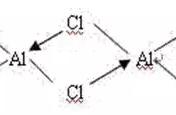
3. 如何表示大π键?
如

指平行于p轨道的数目有3个(一般粒子有几个原子,就是几个p轨道),平行p轨道里的电子数为4。
4. 如何计算大π键中的电子数?
1.确定分子中总价电子数;
2.计算分子中的

键和不与 π键p轨
道平行的孤对电子(含中心和外围中的
电子数);
3.总电子数减去这些

键和孤对电子,剩余的就是填入大 π键的电子。
5. 举例说明?
例1:CO2中的大π键:
分析:(1)CO2中C原子为sp杂化,两端的O原子可视为不杂化。
(2)C原子sp杂化轨道为两个能量相等的Px轨道,其中各含有1个成单电子;Py轴上有1个成单电子;Pz轴上也有1个成单电子。
(3)O原子2s2、2P轨道中其中一个轨道上面均为两个自旋相反的电子。另两个P轨道上的成单电子分别与C原子的sp杂化轨道形成