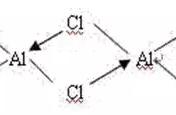
键和π键。
(4)第一套:y轴从左至右的电子数为:1、1、2,共4e—;第二套:z轴从左至右的电子数为:2、1、1,共4e—;均为三个P轨道,故CO2中存在两套

的大π键。
另计算如下:(中心原子C不存在孤对电子)
(1)CO2中的价电子总数为4 6×2=16。
(2)C与O形成

键的电子数为2×2=4。(C和O各拿出1个电子,共2组)
(3)成对电子O原子中:2s、2p中有一个轨道中存在一对孤对电子(共4个),2个O原子共有:4×2=8。
(4)形成大π键的电子,即为剩余电子,共有:16-4-8=4。
(5)O、C、O的每个原子的某一p轨道中共有4个电子可共享,即大π键为

。
例2:NO3—中的大π键:(中心原子N不存在孤对电子)
(1)NO3—中的价电子总数为5 6×3 1=24。
(2)N与O形成