各种典型配合物中配位数的判断
1.配位数可以等同于中心离子(或原子)与配位原子形成的配位键键数,也可以等同于配位体的数目。
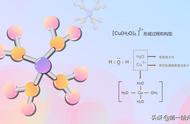
如[Ag(NH3)2]NO3、[Ag(CN)2]-、[Cu(NH3)4]SO4、[Cu(H2O)4]2 、
[Zn(NH3)4]2 、[Zn(CN)4]2-、K3[Fe(SCN)6]、[Fe(CN)6]3-、[FeF6]3-等配合物或配离子中的中心离子与配位体的数目以及配位原子形成的配位键键数均相等,其中Ag 离子的配位数为2,Cu2 离子与Zn2 离子的配位数均为4,Fe3 离子的配位数为6。
一般规律:一般配合物的配位数可以按中心离子电荷数的二倍来计算。
又如Ni(CO)4、Fe(CO)5、Cr(CO)6等羰基化合物中Ni、Fe 、Cr原子的配位数分别为4、5、6。[Co(NH3)4(H2O)2]Cl2、[CrCl(H2O)5]Cl2中Co2 离子与Cr3 离子的配位数均为6。
说明:羰基化合物中的中心原子呈电中性,此类配合物的配位数由化学式直接判断。Co2 离子与Cr3 离子的电荷数分别为2、3,但配位数都是6。所以,配合物的配位数不一定按中心离子(或原子)的电荷数判断。
2.当中心离子(或原子)与多基配体配合时,配位数可以等同于配位原子的数目,但不是配位体的数目。
如[Cu(en)2]中的en是乙二胺(NH2CH2CH2NH2)的简写,属于双基配体,每个乙二胺分子有2个N 原子与Cu2 离子配位,故Cu2 离子的配位数是4而不是2。
3.当中心离子(或原子)同时以共价键与配位键结合时,配位数不等于配位键的键数。
如[BF4]-、[B(OH)4]-、[AlCl4]-、[Al(OH)4]-等配离子中,B、Al原子均缺电子,它们形成的化学键,既有共价键,又有配位键,配位数与配位键的键数不相等,配位数均为4。
又如Al2Cl6(如下左图所示)中Al原子的配位数为4。

再如酞菁钴的结构(如下右图所示),钴离子的配位数为4。

4.当中心离子(或原子)与不同量的配位体配合时,其配位数为不确定。
如硫氰合铁络离子随着配离子SCN-浓度的增大,中心离子Fe3 与SCN- 可以形成配位数为1~6的配合物:[Fe(SCN-)n]3-n (n=1~6)。
注意:中心离子的配位数多少与中心离子和配体的性质(如电荷数、体积大小、电子层结构等)以及它们之间相互影响、配合物的形成条件(如浓度、温度等)有关。配合物的配位数由1到14,其中最常见的配位数为4和6。
各种典型晶体中配位数的判断
1.最密堆积晶体的配位数均为12。
如金属晶体中的两种最密堆积:面心立方最密堆积A1、六方最密堆积A3。
面心立方最密堆积A1(如图所示),

典型代表Cu、Ag、Au,因周围的原子都与该原子形成金属键,以立方体的面心原子分析,上、中、下层各有4个配位原子,故配位数为12。
六方最密堆积A3(如图所示),