氢是一种化学元素,在周期表中排名第一,元素符号为 "H"。氢元素的原子序数为1,原子量为1.008。它是宇宙中最小的原子,也是自然界中最简单的元素。它的分子由两个氢原子组成。它是最轻的气体,其密度大约是空气的1/14倍。它有三种同位素,分别是(i)氕,(ii)氘,和(iii)氚。纯净的氢气无臭、无色、无味。
氢是所有物质中原子量最低的,因此作为气体和液体的密度都很低。在20摄氏度和1个大气压下,氢的蒸汽密度为0.08376公斤/立方米。气态氢的比重为0.0696,因此,它的密度约为空气的7%。在正常沸点和1个大气压下,液态氢的密度为70.8千克/立方米。液态氢的比重为0.0708,因此,它的密度约为水的7%。
氢气在其沸点-253摄氏度以下是液体,在大气压下熔点-259摄氏度以下是固体。它是无毒的,但通过替换空气中的氧气,可以作为一种简单的窒息剂。当氢气作为高压气体在250公斤/立方米和大气温度下储存时,它与大气压力的膨胀率为1:240。
氢气的分子比所有其他气体都要小,它可以通过很多被认为是密闭的或对其他气体不透气的材料扩散。这一特性使得氢气比其他气体更难控制。由于液态氢的沸点极低,液态氢的泄漏会很快蒸发。氢气泄漏是危险的,因为它们在与空气混合的地方构成了火灾的危险。氢气泄漏构成了潜在的火灾危险。
氢气在室温下具有化学稳定性,这主要是由氢气组成的氢原子之间的强共价键决定的。氢分子是一种稳定的分子,具有很高的键能(104千卡/摩尔),但它会与很多不同种类的元素发生反应,与它们形成化合物。
氢气具有还原性。它很轻松与氧气在大多数混合比例下发生反应(燃烧),形成水。这也使得氢气作为一种能源介质成为可能。
氢气的能量密度很差(因为它的密度很低),尽管它的能量与重量比是所有燃料中最好的(因为它很轻)。在1个大气压和15摄氏度的条件下,氢气的能量密度(低热值,LHV)是2400千卡/立方米,液体的能量密度是2030麦卡/立方米。
氢气作为一种可燃气体,只要允许空气进入氢气容器,或氢气从任何容器泄漏到空气中,就会与氧气混合。点火源采取火花、火焰或高热的形式。氢气的闪点低于-253摄氏度。
氢气在空气中的浓度范围很广(4%至75%),在标准大气温度下的浓度范围很广(15%至59%),都是易燃的。氢气在氯气的混合物中也能爆炸(从5%到95%)。可燃性极限随温度升高而增加。因此,即使是小量的氢气泄漏,也有可能燃烧或爆炸。泄漏的氢气会在封闭的环境中集中,从而增加燃烧和爆炸的风险。氢气的燃烧由公式H2 O2 = 2H2O 136 kcal描述。
氢气的自燃温度相对较高,为585摄氏度。这使得在没有其他点火源的情况下,仅凭热量很难点燃氢气/空气混合物。纯粹的氢氧火焰会发出紫外线,肉眼无法看到。因此,检测燃烧的氢气泄漏是很危险的,需要一个火焰检测器。氢气具有非常高的研究辛烷值( 130),因此,即使在非常贫乏的条件下燃烧,也能抗击。
尽管氢气很稳定,但它确实与大多数元素形成了化合物。在参与反应时,当氢与更多的电负性元素如卤素或氧反应时,它可以带部分正电荷,但与更多的电正性元素如碱金属反应时,它可以带部分负电荷。当氢与氟、氧或氮结合时,它可以参与一种叫做氢键的中等强度的非共价(分子间)结合,这对很多生物分子的稳定性至关重要。与金属和类金属有氢键的化合物被称为氢化物。氢的氧化除去了它的电子,产生了具有单一正电荷的氢离子。通常,水溶液中的氢离子被称为氢离子。这个物种在酸碱化学中是必不可少的。
氢的生产
尽管从环境和还原动力学的角度来看,氢气是首选的还原燃料,但目前它很昂贵。然而,人们普遍期望发展氢气经济,从而获得廉价的氢气。大量的努力和很多资源正被投入到这个目标中。氢气的生产目前使用甲烷的重整或水的电解,两者都是能源密集型的过程。目前,直接生产的主导技术是碳氢化合物的蒸汽重整。
大量的氢气通常是通过甲烷或天然气的蒸汽重整来生产的。从天然气中生产氢气是目前最便宜的氢气来源。这个过程包括在蒸汽和镍催化剂的存在下将天然气加热到700摄氏度到1100摄氏度之间。由此产生的内热反应将甲烷分子分解并形成一氧化碳和氢气。然后,一氧化碳气体可以与蒸汽一起通过氧化铁或其他氧化物,进行水气转移反应,以获得更多的氢气。
在这个过程中,高温(700摄氏度至1100摄氏度)蒸汽与甲烷发生内热反应,产生合成气。该反应由方程式CH4 H2O = CO 3H2描述。在第二阶段,通过在360摄氏度左右进行的低温、放热、水气转移反应,产生额外的氢气。从本质上讲,氧原子从额外的水(蒸汽)中被剥离出来,将一氧化碳氧化成二氧化碳。这种氧化也提供了能量来维持反应。驱动该过程所需的额外热量通常由燃烧部分甲烷提供。
然而,有大量的研究工作致力于利用太阳能来生产氢气,例如通过使用太阳能电池来提供电解水所需的电子,或通过光催化水分离,其中太阳光对浸在水中的半导体的作用被用来直接生产氢气。
氢气作为铁矿石的还原剂
在铁的生产过程中,通过在高炉中注入富含氢气的气体,如天然气和焦炉煤气,或废塑料等材料,或在用天然气生产直接还原铁的过程中,正在用氢气结合一氧化炭对铁矿石进行还原。用氢气还原铁矿石以生产纯铁和水的基本化学反应如下:
Fe2O3 3H2 = 2Fe 3H2O
Fe3O4 H2 = 3FeO H2O
FeO H2 = Fe H2O
每吨铁的氢气消耗量约为500 N cum。
铁矿石与一氧化炭和氢气的还原平衡是众所周知的。在850摄氏度以上,氢气的还原能力甚至比一氧化碳更强。氢气在原子上很小,具有很高的扩散性,被认为是更快的还原剂,因此提供了快速还原过程的前景,并且没有温室气体排放。图1给出了用一氧化二碳和氢气进行还原的平衡图。
从图1的平衡图可以看出,在低温下,一氧化二碳对铁的还原更有效,而在高温下,氢气对氧化铁的还原更有效。
图1 用一氧化二碳和氢气进行还原的平衡图
图2(a)显示了在颗粒的情况下可以接近平衡极限的程度。气体利用率是温度的一个函数,并取决于还原程度。没有达到热力学极限。对于流化床反应器中的矿粉,反应动力学更为复杂。图2(b)显示了一个典型的赤铁矿粉在实验室炉子里被50%的氢气和50%的氮气混合物在450摄氏度和800摄氏度之间还原时的还原特性。
图2 氢气的气体利用率与温度和还原度的关系
气体利用率取决于温度和还原度。起初,气体利用率很高,但在50%至60%的还原后就会下降,特别是在700摄氏度左右的温度下。原因是速率最小效应,这归因于固相的形态变化,通常发生在600摄氏度和750摄氏度之间。一个原因是水蒸气对反应FeO H2 = Fe H2O的延缓作用。
流化床的另一个限制因素是粘附,即通过矿石颗粒之间的粘附实现去流化。它导致了流化床的破裂,也取决于矿石细粒的类型和还原程度。流化床中的氢气还原只有在分阶段进行的情况下才能实现,这些阶段的选择取决于每个细矿石的具体还原程度。已经为几种赤铁矿和磁铁矿建立了类似的图表。
氢气还原过程
如下所述,铁矿石有几种氢气还原工艺。
竖炉用于用重整天然气还原铁矿石托盘,重整天然气是氢气和一氧化碳的混合物。两个最相关的直接还原工艺是Midrex和Energiron(HYL-III)。
Midrex工艺通常应用1到1.5之间的氢气/一氧化二碳比例,但能够用氢气和一氧化二碳的任何组合还原铁矿石。由于氧化铁的内热还原,使用氢气改善的反应动力学预计会被较低的炉料温度所抵消。目前,没有使用100%氢气的Midrex设备,这只是出于经济考虑。
Energiron直接还原工艺旨在通过基于氢气和一氧化二碳的化学反应,将铁球/块矿转化为金属铁。该工艺的关键方面是独立控制金属化和产品碳。Energiron直接还原工艺是基于零重整器(ZR)方案。
Circored工艺是一种流化床工艺,从铁矿粉中生产直接还原铁块,并使用纯氢作为还原剂。在这个过程中,铁矿粉被干燥,并通过天然气的燃烧在高达850摄氏度至900摄氏度的温度下加热。该过程所需的氢气是由外部蒸汽转化器从天然气中产生的。
碳热还原的另一种方法是使用氢气等离子体进行还原,氢气等离子体包括振动激发的分子、原子和离子状态的氢气,所有这些都可以还原氧化铁,甚至在低温下。除了氢气等离子体的热力学和动力学优势,反应的副产品是水,不会造成任何环境问题。等离子状态下的氢气为还原提供了热力学和动力学上的优势,因为存在原子、离子以及振动激发的氢气物种。这些物种所携带的能量可以在还原界面释放,导致局部加热。因此,氢气等离子体的还原不需要像分子氢那样进行体积加热。这使得反应器的热损失得以减少,并伴随着成本的节约。氢气等离子体对氧化铁的还原可以发生在氧化铁的不同物理状态下。根据反应界面上的氧化铁的物理状态,氧化铁的氢气等离子体还原可以分为两类,即(i)异质过程,其中还原反应发生在氢气和熔融或固体氧化铁的界面上,以及(ii)同质过程,其中氧化铁被汽化,所以反应发生在气相中。均相过程也可称为解离还原。绝大多数工艺都是异质性的,但同质性工艺的特点是有启发的。
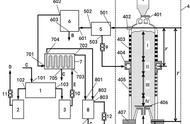
美国钢铁协会正在开发一种闪光炼铁工艺,其中氢气被用作还原剂。该工艺的能量需求为每吨热金属2.6千兆卡。该工艺的流程图见图3。在闪速炼铁炉中,操作温度为1325摄氏度,停留时间为2秒至10秒。停留时间是由温度引起的反应速度、进料的大小和过剩气体的数量/离平衡线的距离组成的。
,