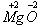混合物是多种物质混合在一起而形成的物质,根据一定条件求出其中某元素的质量分数是一种常见的习题类型。在条件足够时,计算当然不是问题,在条件不足时,就要充分挖掘隐藏在化学式中的信息,从而求出某元素的质量分数。
下面就几种常见类型分类归纳其求解方法。
一、两种元素质量比相同
例题1.在FeSO4、Fe2(SO4)3的混合物中,若硫的质量分数22%,则铁的质量分数为多少?
解析:因FeSO4和Fe2(SO4)3中硫元素和氧元素的原子个数比均为1:4,质量比均为1:2,所以,ω(S) =22%,ω(O)=44%,则ω(Fe)=1-22%-44%=34%
练习:在Na2S、Na2SO3和Na2SO4的混合物中,若钠的质量分数为46%,则氧的质量分数为多少?
(答案22%)
二、某两种元素可化成定比形式
例题2.有苯、乙酸和乳酸组成的混合物,经测定含碳元素质量分数为48.0%,则此混合物中氧的质量分数为多少?
解析:将C6H6, C2H4O2, C3H6O3分别变换成(CH)6, (CH)2(OH)2, (CH)3(OH)3,因此整个混合物可看成是若干个CH和若干个OH组成。
∵ω(C)=48.0%,∴ω(CH)=48.0%×13/12=52.0%,
ω(OH)=1-52%=48%,ω(O)=48.0%×16/17=45.2%
练习:将环戊烷、己烯、乙醇混合,若混合物中碳的质量分数为65.8%,则混合物中氧的质量分数为多少?(答案20.7%)
三、某元素质量分数相同
例题3.甲苯和丙三醇组成的混合物中,若含碳的质量分数为58%,那么氢元素的质量分数为多少?
解析:两者的化学式分别为C7H8和C3H8O3,物质组成不符合定比形式,也不能通过变式化成定比,仔细分析发现两者相对分子质量恰好相等,都为92,且分子中都含有8个H原子,所以氢元素的质量分数为:ω(H)=8×1÷92×100%=8.7%
练习:尿素〔CO(NH2)2〕和乙酸组成的混合物中,若含氧的质量分数为40%,那么可推断氢元素的质量分数是多少?(答案6.7%)



PS:有什么想要了解的知识可以在文末留言给化学姐,化学姐一定会尽力帮助大家的~