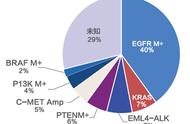
截至2016年12月,CFDA目前批准了20种针对肿瘤的靶向药物,现总结如下。
1、阿帕替尼
阿帕替尼(Apatinib),商品名艾坦,药物作用靶点为VEGFR-2,阿帕替尼是一种小分子VEGFR-2酪氨酸激酶抑制剂,可抑制肿瘤血管生成。动物研究表明可明显抑制多种小鼠肿瘤模型的肿瘤生长。中国国家食品药品监督管理总局(CFDA)批准阿帕替尼单药治疗至少接受过2种系统化疗后进展或复发的晚期胃腺癌或胃-食道结合部腺癌患者。至少接受过2种系统化疗后进展或复发的晚期胃腺癌或胃-食道结合部腺癌患者。未获FDA批准。原研药企为恒瑞医药 (2014年)。主要针对的癌种为胃癌和结直肠癌。
2、阿昔替尼
阿昔替尼(Axitinib),商品名英立达(Inlyta),药物作用靶点有VEGFR-1、VEGFR-2、VEGFR-3。FDA批准阿昔替尼用于既往接受过全身治疗且失败的晚期肾细胞癌患者。CFDA批准其用于接受至少一种既往全身治疗失败的晚期肾细胞癌。阿昔替尼是一种激酶抑制剂,在治疗剂量的血药浓度可抑制酪氨酸激酶受体包括血管内皮生长因子受体VEGFR-1、VEGFR-2和VEGFR-3。这些受体与病理性血管生成、肿瘤生长和癌症的进展有关。原研药企为Pfizer (2012年)。主要针对的癌种为肾细胞癌。
3、贝伐珠单抗
贝伐珠单抗(Bevacizumab),商品名安维汀(Avastin),药物作用靶点为VEGF。
FDA批准贝伐单抗的适应症为:
①顽固、复发或转移性宫颈癌;
②转移性结直肠癌;
③既往治疗后进展的胶质母细胞瘤;
④不可切除、局部晚期、复发或转移的非鳞状非小细胞肺癌;
⑤铂类耐药、复发的上皮性卵巢癌、输卵管癌和原发性腹膜癌;
⑥转移性肾细胞癌。
FDA批准贝伐珠单抗用于:
①作为一线或二线治疗,以静脉注射5-氟尿嘧啶的化疗为基础联合治疗转移性结直肠癌;
②作为二线治疗,以氟尿嘧啶-伊立替康或氟嘧啶-奥沙利铂的化疗为基础联合治疗既往接受过含贝伐珠单抗的一线治疗方案但疾病仍有进展的转移性结直肠癌患者;
③作为一线治疗,与含卡铂和紫杉醇的化疗联合治疗不可切除的、局部晚期、复发或转移的非鳞状非小细胞肺癌患者;
④作为一种单药治疗既往治疗后疾病仍有进展的成人胶质母细胞瘤患者;
⑤与干扰素α联合治疗转移性肾细胞癌;
⑥与紫杉醇-顺铂或紫杉醇-拓扑替康联合治疗持续性、复发性或转移性宫颈癌;
⑦与紫杉醇-脂质体阿霉素或紫杉醇-拓扑替康联合治疗铂类耐药的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌。
CFDA批准其在中国上市,批准贝伐单抗用于:
①转移性结直肠癌;
②晚期、转移性或复发性非小细胞肺癌。
贝伐珠单抗是一种血管内皮生长因子特异性血管生成抑制剂。贝伐珠单抗可结合VEGF并预防VEGF在内皮细胞表面与它的受体相互作用。原研药企为Roche (2004年)。主要针对的癌种为非小细胞肺癌(腺癌)、非小细胞肺癌、结直肠癌、肾细胞癌、宫颈癌、卵巢癌、胶质母细胞瘤和腹膜癌。
4、硼替佐米
硼替佐米(Bortezomib),万珂(Velcade),药物作用靶点为26S蛋白酶体。
FDA批准适应症:
①多发性骨髓瘤;
②套细胞淋巴瘤。
CFDA批准其适应症为:
①多发性骨髓瘤;
②套细胞淋巴瘤。
硼替佐米是一种蛋白酶抑制剂,可以抑制26S蛋白酶体,从而影响多种细胞信号转导通路。原研药企为Janssen, Takeda & Millennium (2003年)。主要针对的癌种为淋巴瘤和骨髓瘤。
5、西妥昔单抗
西妥昔单抗(Cetuximab),爱必妥(Erbitux),药物作用靶点为EGFR。
FDA批准适应症为:
①KRAS野生型、EGFR表达的转移性结直肠癌;
②头颈部鳞状细胞癌。
FDA批准西妥昔单抗用于:
①与放疗联合治疗头颈部局部或区域晚期鳞状细胞癌;
②与以5-氟尿嘧啶和铂类为基础的治疗联合治疗头颈部局部复发性或转移性鳞状细胞癌;
③治疗以铂类为基础的治疗后再进展的头颈部复发性或转移性鳞状细胞癌;
④与FOLFIRI方案的一线治疗联合治疗K-Ras野生型、表达EGFR的转移性结直肠癌;
⑤与伊利替康联合治疗K-Ras野生型、表达EGFR的、且伊立替康为基础的化疗难治的转移性结直肠癌;
⑥作为单药治疗K-Ras野生型、表达EGFR的、且对以奥沙利铂和伊立替康为基础的化疗无效或对伊立替康不能耐受的转移性结直肠癌患者。
CFDA批准其适应症为KRAS野生型、EGFR表达的转移性结直肠癌。
西妥昔单抗是表皮生长因子受体(EGFR)拮抗剂,在正常细胞和肿瘤细胞中它可与表皮生长因子受体特异性结合,竞争性抑制表皮生长因子(EGF)和其他配体的结合,如转化生长因子-α。原研药企为Imclone & Merck (2004年)。主要针对的癌种为结直肠癌和头颈肿瘤。
6、西达本胺
西达本胺(Chidamide),爱谱沙(Epidaza),药物作用靶点为HDAC。未获FDA批准。西达本胺是一种苯酰胺类组蛋白去乙酰化酶(Histone Deacetylase,HDAC)亚型选择性抑制剂,主要针对第I类HDAC中的1、2、3亚型和第IIb类的10亚型,具有对肿瘤异常表观遗传功能的调控作用。CFDA批准西达本胺用于治疗既往至少接受过一次全身化疗的复发或难治的外周T细胞淋巴瘤(PTCL)患者。原研药企为微芯生物 (2014),主要针对的癌种为淋巴瘤。
7、达沙替尼
达沙替尼(Dasatinib),施达赛(Sprycel),药物作用靶点为BCR-ABL,SRC家族(SRC、LCK、YES、FYN),c-KIT,EPHA2,PDGFRβ。
FDA批准适应症为费城染色体阳性的慢性髓细胞白血病和费城染色体阳性的急性淋巴细胞白血病。
美国FDA批准达沙替尼用于治疗:
①新诊断为费城染色体阳性(pH )的慢性粒细胞白血病(CML)的慢性期成人患者;
②费城染色体阳性(pH )的慢性期、加速期或骨髓/淋巴急变期慢性粒细胞白血病患者,该患者必须对之前接受的伊马替尼治疗耐药或不能耐受;
③费城染色体阳性的急性淋巴细胞白血病患者,且对之前接受的治疗耐药或不能耐受。
CFDA批准的适应症为伊马替尼耐药或不耐受的费城染色体阳性慢性髓细胞白血病。
达沙替尼在纳摩尔浓度,抑制以下激酶:BCR-ABL,SRC家族(SRC、LCK、YES、FYN),c-KIT,EPHA2,PDGFRβ。原研药企BMS (2006年)。主要针对的癌种为白血病。
8、厄洛替尼
厄洛替尼(Erlotinib),特罗凯(Tarceva),药物作用靶点为野生型EGFR、19外显子缺失或L858R突变的EGFR。
FDA批准的适应症为:
①EGFR基因第19外显子缺失或第21外显子突变(L858R)的转移性非小细胞肺癌;
②局部晚期、无法手术切除或转移性胰腺癌。
美国FDA批准厄洛替尼用于:
①作为一线、维持、至少一次化疗进展后的二线或更多线治疗方案,用于EGFR基因第19外显子缺失或第21外显子突变(L858R)的转移性非小细胞肺癌;
②作为一线治疗方案,与吉西他滨联合治疗局部晚期、不可切除的转移性胰腺癌。
厄洛替尼是一种口服的选择性表皮生长因子受体(EGFR)酪氨酸激酶抑制剂。CFDA批准的适应症为至少一个化疗方案失败后的局部晚期或转移的非小细胞肺癌。
原研药企为Roche (2004年)。主要针对的肿瘤为非小细胞肺癌和胰腺癌。
9、依维莫司
依维莫司(Everolimus),飞尼妥(Afinitor),药物作用靶点为mTOR。
FDA批准的适应症为:
①胰腺来源进展期神经内分泌瘤;
②胃肠来源进展期、分化良好、无功能的不可切除、局部晚期或转移性神经内分泌瘤;
③肺来源进展期、分化良好、无功能的不可切除、局部晚期或转移性神经内分泌瘤;
④舒尼替尼或索拉非尼治疗失败的晚期肾细胞癌;
⑤肾错构瘤和结节性硬化症;
⑥结节性硬化症患者的室管膜下巨细胞性星形细胞瘤;
⑦绝经后激素受体阳性、HER2阴性的晚期乳腺癌。
美国FDA批准依维莫司用于治疗:
①与依西美坦联合治疗晚期激素受体阳性、HER2阴性、绝经后女性的乳腺癌患者,该患者必须是之前接受过来曲唑或阿那曲唑治疗且失败的;
②成人的胰腺神经内分泌肿瘤(PNET)患,以及成人胃肠道(GI)或肺源性的进展期的分化良好、无功能性的不可切除、局部晚期或转移性神经内分泌肿瘤(NET)(不适用于有功能性的类癌);
③舒尼替尼或索拉非尼治疗失败的晚期肾细胞癌(RCC);
④无需立即手术的成人肾血管平滑肌脂肪瘤和结节性硬化症(TSC);
⑤结节性硬化症儿童或成人患者所患的,需要治疗但无法根治切除的室管膜下巨细胞性星形细胞瘤(SEGA)。
依维莫司是mTOR (PI3K /Akt信号通路下游的一种丝氨酸 /苏氨酸激酶)的抑制剂;此外,还可抑制缺氧诱导因子(如HIF-1)的表达和降低VEGF的表达。由于TSC1、TSC2是mTORC1信号的调节器,故依维莫司对TSC1、TSC2的丢失/灭活引起的下游信号激活有效。
CFDA批准的适应症为:
①晚期肾细胞癌;
②结节性硬化症患者的室管膜下巨细胞性星形细胞瘤。
原研药企为Novartis (2009年)。主要针对的肿瘤为乳腺癌、肾细胞癌、神经内分泌瘤和结节性硬化症室管膜下巨细胞性星形细胞瘤。
10、吉非替尼
吉非替尼(Gefitinib),易瑞沙(Iressa),药物作用靶点为野生型EGFR、19外显子缺失或L858R突变的EGFR、IGF、PDGF。FDA批准的适应症为EGFR第19外显子缺失或21外显子突变(L858R)的转移性非小细胞肺癌。美国FDA批准吉非替尼作为一线方案治疗EGFR基因第19外显子缺失或第21外显子突变(L858R)的转移性非小细胞肺癌。
吉非替尼是一种口服的选择性表皮生长因子受体(EGFR)酪氨酸激酶抑制剂。CFDA批准的适应症为局部晚期或转移性非小细胞肺癌。原研药企为AstraZeneca (2003)。主要针对的肿瘤为非小细胞肺癌。
11、埃克替尼
埃克替尼(Icotinib),凯美纳,药物作用靶点为EGFR,未获FDA批准。埃克替尼是一种选择性表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,对野生型和突变型EGFR均有抑制作用。CFDA批准的适应症为EGFR敏感突变的局部晚期或转移性非小细胞肺癌(NSCLC)的一线治疗,或既往接受过至少一个化疗方案(主要铂类药物为基础)失败的局部晚期或转移性NSCLC的治疗。
原研药企为贝达 (2011年)。主要针对的肿瘤为非小细胞肺癌。
12、伊马替尼
伊马替尼(Imatinib),格列卫(Gleevec),药物作用靶点为c-KIT,PDGFR,ABL。
FDA批准的适应症为:
①慢性期的费城染色体阳性的慢性髓细胞白血病,新发慢性期的成人和儿童患者以及干扰素α治疗失败的患者;
②费城染色体阳性的急性淋巴细胞白血病,复发或难治成人患者,或新发儿童患者;
③侵袭性系统性肥大细胞增生症,无D816Vc-Kit基因突变或未知c-Kit基因突变的成人患者;
④嗜酸细胞增多症和/或慢性嗜酸性粒细胞白血病的成人患者;
⑤KIT阳性的不可切除和/或转移性恶性胃肠道间质瘤,及KIT阳性胃肠道间质瘤术后高复发风险成人患者的辅助治疗;
⑥不可切除、复发的或转移性的隆突性皮肤纤维肉瘤的成人患者;
⑦PDGFR基因重排相关的骨髓增生异常综合征/骨髓增生性疾病的成人患者。
美国FDA批准伊马替尼用于用于治疗:
①新诊断的费城染色体阳性的慢性粒细胞白血病(Ph CML)的慢性期的成人或儿童患者;
②干扰素α治疗失败后的费城染色体阳性的慢性粒细胞白血病(Ph CML)的慢性期、加速期或急变期;
③复发或难治性费城染色体阳性的急性淋巴细胞白血病(Ph ALL)的成人患者;
④与化疗联合治疗新诊断的费城染色体阳性急性淋巴细胞白血病(Ph ALL)的儿童患者;
⑤与PDGFR(血小板衍生生长因子受体)基因重排有关的成人骨髓增生异常/骨髓增生性疾病(MDS/MPD);
⑥无c-Kit D816V突变或c-Kit突变状态未知的侵袭性系统性肥大细胞增生症成人患者;
⑦嗜酸性粒细胞增多综合征(HES)和/或慢性嗜酸性粒细胞白血病(CEL)的成人患者;
⑧不可切除的、复发的和/或转移性的隆突性皮肤纤维肉瘤(DFSP)成人患者;
⑨Kit (CD117)阳性的不能切除和/或转移性的恶性胃肠道间质瘤(GIST)的成人患者;
⑩作为辅助治疗用于Kit (CD117)阳性的已手术切除的胃肠道间质瘤(GIST)的成人患者。
伊马替尼是一种蛋白酪氨酸激酶抑制剂,抑制BCR-ABL酪氨酸激酶,也是血小板衍生的生长因子(PDGF)、干细胞因子(SCF)和c-kit的受体酪氨酸激酶抑制剂,同时也抑制PDGF、SCF介导的细胞活动。
CFDA批准的适应症为:
①费城染色体阳性的慢性髓性白血病的慢性期、加速期或急变期;
②复发的或难治的费城染色体阳性的急性淋巴细胞白血病;
③复发的或难治的费城染色体阳性的急性淋巴细胞白血病;
④嗜酸细胞过多综合症和/或慢性嗜酸粒细胞白血病伴有FIP1L-PDGFRα融合激酶的成年患者;
⑤用于治疗不能切除和/或发生转移的恶性胃肠道间质瘤的成人患者;
⑥不能切除,复发的或发生转移的隆突性皮肤纤维肉瘤;
⑦骨髓增生异常综合症/骨髓增生性疾病伴有PDGFR基因重排的成年患者。
原研药企为Novartis (2001年)。主要针对的肿瘤为胃肠道间质瘤,白血病。
13、拉帕替尼
拉帕替尼(Lapatinib),泰立沙(Tykerb),药物作用靶点为HER2和EGFR。FDA批准的适应症为:HER2阳性的晚期或转移性乳腺癌。
美国FDA批准拉帕替尼用于治疗:
①与卡培他滨联合治疗过度表达HER2的进展性或转移性乳腺癌,且其之前接受过包括蒽环类、紫杉醇和曲妥珠单抗的治疗;
②与来曲唑联合治疗绝经后激素受体阳性的HER2过表达的转移性乳腺癌,且已应用过激素治疗的。
拉帕替尼是一种4-苯胺基喹唑啉类激酶抑制剂,抑制表皮生长因子受体(EGFR)和人类表皮生长因子受体2型(HER2)的细胞内酪氨酸激酶域。CFDA批准的适应症为HER2阳性的晚期或转移性乳腺癌。
原研药企为GSK & Novartis (2007年)。主要针对的肿瘤为乳腺癌。
14、尼洛替尼
尼洛替尼(Nilotinib),达希纳(Tasigna),药物作用靶点为ABL、PDGFR、c-KIT、CSF-1R和DDR1。FDA批准的适应症为费城染色体阳性的慢性髓细胞白血病。
美国FDA批准尼洛替尼用于:
①费城染色体阳性的慢性粒细胞白血病(Ph CML)慢性期的治疗;
②费城染色体阳性的慢性粒细胞白血病(Ph CML)患者的慢性期或加速器的治疗,且该患者必须是对之前的治疗(包括伊马替尼)耐药或不能耐受。
尼洛替尼是一种BCR-ABL激酶抑制剂。CFDA批准的适应症为对既往治疗(包括伊马替尼)耐药或不耐受的费城染色体阳性的慢性髓性白血病慢性期或加速期成人患者。
原研药企为Novartis (2007年)。主要针对的肿瘤为白血病。
15、尼妥珠单抗
尼妥珠单抗(Nimotuzumab),泰欣生,药物作用靶点为EGFR,未获FDA批准。尼妥珠单抗是一种抗表皮生长因子受体(EGFR)的人源单克隆抗体,可阻断EGFR与其配体的结合,并对EGFR过度表达的肿瘤具有抗血管生成、抗细胞增殖和促凋亡作用。CFDA批准尼妥珠单抗联合放疗治疗EGFR表达阳性的Ⅲ/Ⅳ期鼻咽癌。原研药企为百泰生物(2012年)。主要针对的肿瘤为头颈肿瘤,鼻咽癌。
16、利妥昔单抗
利妥昔单抗(Rituximab),美罗华(Mabthera),药物作用靶点为CD20。
FDA批准的适应症为:
①非霍奇金淋巴瘤;
②慢性淋巴细胞白血病;
③类风湿性关节炎;
④成人多血管炎性肉芽肿和显微镜下多血管炎。
美国FDA批准利妥昔单抗用于治疗:
①非霍奇金淋巴瘤(NHL);
②慢性淋巴细胞白血病(CLL);
③与氨甲喋呤联合治疗对一个或一个以上的TNF拮抗剂治疗反应不足的成人中度至重度活动性类风湿性关节炎(RA);
④与糖皮质激素联合治疗成人肉芽肿血管炎(GPA)(韦格纳肉芽肿)和显微镜下型(多)血管炎(MPA)。
利妥昔单抗是一种单克隆抗体,靶向前B细胞和成熟B淋巴细胞表面表达的CD20抗原。CFDA批准用于复发或耐药的滤泡性中央型淋巴瘤/B细胞非霍奇金淋巴瘤。原研药企为Roche (1997年)。主要针对的肿瘤为白血病,淋巴瘤。
17、索拉非尼
索拉非尼(Sorafenib),多吉美(Nexavar),药物作用靶点为VEGFR1、VEGFR2、VEGFR3、PDGFRβ、KIT、FLT-3、BRAF,突变型BRAF、CRAF、RET、RET/PTC。
FDA批准的适应症为:
①不能手术切除的肝细胞癌;
②晚期肾细胞癌;
③局部复发或转移、进展、放射性碘治疗难治的分化甲状腺癌。
美国FDA批准索拉非尼用于治疗不能切除的肝细胞癌或晚期肾细胞癌,以及局部复发或转移、进展、放射性碘治疗难治的分化甲状腺癌。
索拉非尼是一种激酶抑制剂,能够抑制多种跨膜(CRAF, BRAF)以及细胞表面激酶(KIT、FLT-3、RET、RET/PTC、VEGFR-1、VEGFR-2、VEGFR-3和PDGFR-β)。
CFDA批准用于:
①无法手术或远处转移的肝细胞癌;
②不能手术的晚期肾细胞癌。
原研药企为Bayer (2005年)。主要针对的肿瘤为肝癌、肾细胞癌和甲状腺癌。
18、舒尼替尼
舒尼替尼(Sunitinib),索坦(Sutent),药物作用靶点为VEGFR1、VEGFR2、VEGFR3、PDGFRα、PDGFRβ、KIT、FLT3、CSF-1R和RET。
FDA批准的适应症为:
①胃肠道间质细胞瘤;
②晚期肾细胞癌;
③不能切除局部晚期或转移、进展、分化良好的胰腺神经内分泌瘤。
美国FDA批准舒尼替尼用于治疗:
①伊马替尼治疗失败或不能耐受的胃肠道间质瘤(GIST);
②晚期肾细胞癌(RCC);
③不能手术切除的局部晚期或转移性的、进展的分化良好的胰腺神经内分泌肿瘤(PNET)的患者。
舒尼替尼是一种多激酶抑制剂,可以抑制PDGFR、VEGFR、KIT、FLT3、CSF-1R和RET。
CFDA批准用于:
①甲磺酸伊马替尼治疗失败或不能耐受的胃肠间质瘤;
②不能手术的晚期肾细胞癌。
原研药企为Pfizer (2006年)。主要针对的肿瘤为胃肠道间质瘤、肾细胞癌和神经内分泌瘤。
19、曲妥珠单抗
曲妥珠单抗(Trastuzumab),赫赛汀(Herceptin),药物作用靶点为HER2。
FDA批准的适应症为:
①HER2过表达的乳腺癌;
②HER2过表达的转移性胃腺癌和胃食管交界腺癌。
美国FDA批准曲妥珠单抗用于治疗:
①HER2过表达的乳腺癌;
②HER2过表达的转移性胃腺癌或胃食管交界处腺癌。
曲妥珠单抗是一种HER2/neu受体拮抗剂。
CFDA批准用于:
①HER2 阳性的转移性乳腺癌,和术后、化疗和放疗后的HER2阳性乳腺癌辅助治疗;
②HER2阳性的转移性胃腺癌或胃食管交界腺癌。
原研药企为Roche (1998年)。主要针对的肿瘤为胃癌,胃-食道交界腺癌。
20、克唑替尼
克唑替尼(Crizotinib),赛可瑞(Xalkori),药物作用靶点为ALK、c-MET、ROS1和RON。FDA批准的适应症为ALK阳性或ROS1阳性的转移性非小细胞肺癌。克唑替尼是一种酪氨酸激酶受体抑制剂,可抑制HGFR、c-Met、ROS1和RON。CFDA批准用于ALK阳性的局部晚期或转移性非小细胞肺癌。原研药企为Pfizer (2011年)。主要针对的肿瘤为非小细胞肺癌。
,