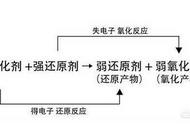
归中反应发生规律图
为了更加直观的理解什么叫做“不能价态交叉”,我们来看二氧化硫和硫酸反应的方程式进行理解:
H2S H2SO4 == S↓ SO2 2H2O
我们很容易看出硫化氢的S为-2价,硫酸的S为 6价;硫单质的S为0价,二氧化硫的S为 4价。那么请看下图:

二氧化硫和硫酸反应变价分析图
那么由此我们得知,硫化氢是还原剂,硫酸是氧化剂;硫单质是氧化产物,二氧化硫是还原产物。
ii. 大多数物质在反应中做氧化剂还是还原剂并不是一成不变的(包括上述列举也是如此)。通常取决于其与其他物质性质的关系。
如上述常见氧化剂中的过氧化氢(氧为-1价处于中间价态),在酸性条件下可以被高锰酸钾氧化:
2KMnO4 5H2O2 2H2SO4 == K2SO4 MnSO4 5O2↑ 2H2O
iii.同一种氧化剂对应的还原产物不是一成不变的,同理,同一种还原剂对应的氧化产物也不是一成不变的。通常会受反应浓度、反应酸碱度等因素影响。
如铜(还原剂)和硝酸(氧化剂)反应。当硝酸为浓硝酸,反应的还原产物是二氧化氮;当硝酸为稀硝酸,反应的还原产物为一氧化氮。
氧化剂高锰酸钾在酸性条件下的还原产物通常为锰离子,而在中性或碱性条件下的还原产物通常为锰酸钾或二氧化锰。
5.电子转移的表示方法
①单线桥法

箭头由还原剂中被氧化的元素指向氧化剂中被还原的元素,箭头方向为电子转移方向。
在桥上标明转移电子总数。
②双线桥法

箭头分别由氧化剂指向还原产物,由还原剂指向氧化产物;箭头两端所指元素相同;箭头不表示电子转移方向,仅表示电子转移前后的变化。
在桥上标明得失电子数量;得失电子总数相等。
二、氧化性还原性的强弱规律
1.氧化性还原性与元素周期表的关系