⒈ 实验原理:
乙醇分子是由乙基C2H5-和羟基-OH组成的,羟基比较活泼,它决定着乙醇的主要性质。
⒉ 实验操作:
⑴ 向试管中加入约2mL无水乙醇,用镊子取一小块钠,用滤纸吸干表面的煤油,将钠投入乙醇中,观察发生的现象。并迅速用一配有导管的单孔塞塞住试管口,用一小试管倒扣在导管上,收集反应中放出的气体并验纯。(可以用钠与水反应作对比试验)
⑵ 向试管里注入约2mL无水乙醇,取一根光洁的铜丝绕成螺旋状,放在酒精灯外焰上加热至红热,然后伸入无水乙醇中,反复几次。观察铜丝的变化,闻试管中液体的气味。
⒊ 实验现象及结论:
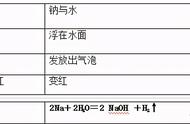
⑴钠沉在乙醇底部,形状不变,表面有气泡产生,然后逐渐上升到乙醇表面,体积逐渐减小,最后消失。触摸试管壁,感觉较热。小试管用排气法收集所放出的气体,在试管口点燃,可以听到爆鸣声,证明放出的是氢气。
2Na 2CH3CH2OH→2CH3CH2ONa H2↑
说明乙醇能和活泼金属钠发生置换反应,乙醇具有类似水的性质,但乙醇和钠反应较平稳,不如水和钠反应剧烈,乙醇羟基(-OH)中的氢原子不如水中的氢原子活泼。
⑵铜丝表面变黑,伸入无水乙醇后又复原成红色,溶液有刺激性气味。铜丝先和氧气反应生成黑色的氧化铜,氧化铜被乙醇还原生成铜,如此反复操作数次,即能闻到有刺激性气味的乙醛生成。
2Cu O2=2CuO,
CuO CH3CH2OH→CH3CHO Cu H2O
总反应的方程式:2CH3CH2OH O2=2CH3CHO 2H2O
说明在一定条件下,乙醇可被氧化成乙醛。

⒋ 关于乙醇与金属钠的反应
⑴ 本实验如果多加几粒金属钠,开始时反应较快,乙醇与钠反应放出氢气,溶液逐渐变稠,但当钠的表面被乙醇钠包住后,反应又逐渐变慢。这时稍稍加热可使反应加快。然后静置或用冷水冷却,乙醇钠就从溶液中析出。若试管上用带尖嘴玻璃导管的塞子塞住,用小试管收集气体,可检验证明该气体是氢气。
用玻璃棒蘸取1~2滴反应后的溶液在玻璃片上蒸发,则玻璃片上有乙醇钠晶体析出。向乙醇钠溶液中加1mL~2mL水,因乙醇钠遇水分解生成乙醇和氢氧化钠,用pH试纸能检验溶液呈碱性。
⑵ 实验后要及时处理反应后的物质。最好是再加入乙醇使金属钠完全反应。若钠有剩余,在放水冲洗时小心会出现爆炸。
⒌ 问题:
⑴ 试写出乙醇分别与钾、镁、铝反应的化学方程式。
⑵ 在乙醇氧化实验中,为什么铜丝一端要卷成螺旋状?为什么要反复操作数次?该实验中乙醇可还原CuO,请小结中学化学中有哪些物质可还原CuO?
⑶ 对饮酒后驾车的嫌疑人检验其呼气酒精含量的方法是:利用橙红色重铬酸钾(酸性溶液)放在气体酒精含量探测器中进行检验,让司机对填充了吸附有K2Cr2O7的硅胶颗粒的装置吹气。若发现硅胶变色达到一定程度,即可证明司机是酒后驾车。其化学原理是K2Cr2O7在酒精作用下转变为绿色Cr2(SO4)3,这是利用了乙醇的哪些性质?
⑷ 电工师傅在焊接铜漆包线的线头时,常把线头放在火上烧一下,然后用酒精处理后再焊接.如此处理后再焊接的目的是什么呢?焊接银器、铜器时,表面会生成发黑的氧化膜,银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜、银会光亮如初!这是何原理?