实验一
配制一定物质的量浓度的溶液
(1)主要仪器
固体溶解:托盘天平、烧杯、玻璃棒、容量瓶、胶头滴管,
溶液稀释:量筒、烧杯、玻璃棒、容量瓶、胶头滴管

(2)注意事项
①容量瓶:只有一个刻度线,只能配制瓶上规定容积的溶液,若配制480 mL溶液应用500 mL容量瓶。
②写所用仪器时,容量瓶必须注明规格。
③容量瓶使用之前必须查漏。
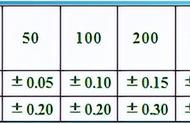
(3)误差分析依据:

焰色反应
(1)步骤:洗—烧—蘸—烧—洗—烧。
(2)用品:铂丝或光洁无锈的铁丝、稀盐酸、样品。
(3)注意事项:焰色反应是物理变化;Na,
K的焰色:黄色、紫色(透过蓝色的钴玻璃)。
实验三钠和过氧化钠
(1)取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的外皮。现象:在钠新切口处可以观察到银白色的金属光泽,切口处在空气中很快变暗(氧化成Na2O)。
(2)把一小块金属钠放在坩埚里加热。现象:钠先熔化成小球,然后燃烧,发出黄色火焰,生成淡黄色的固体(生成Na2O2)。
(3)向盛有水的小烧杯中滴入几滴酚酞溶液,把一小块钠放入水中。现象:钠浮在水面上(密度比水小),熔成小球(反应放热、钠的熔点低),小球四处游动,并有嘶嘶的响声(有气体产生),溶液变为红色(生成碱性物质)。
(4)把水滴入盛有少量Na2O2固体的试管中,立即把带火星的木条放在试管口,检验生成的气体,该反应放出大量的热,同时产生O2。
实验四鉴别Na2CO3和NaHCO3
分别用Na2CO3和NaHCO3做实验,观察现象。