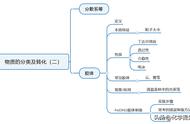
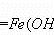一、胶体与其它分散系的区别
提示:根据分散质微粒直径的大小,可以将分散系分为胶体、浊液和溶液三大类。因此本质区别在于分散质粒子直径不同,“结构决定性质”。
注意题目中的易混淆选项,如本质区别为是否产生丁达尔效应,这种说法是错误的。
二、胶体的纯化,与溶液的“鉴别”
提示:做题时要区分是鉴别还是分离。
鉴别胶体与溶液的方法——丁达尔效应。
纯化胶体可以采用渗析的方法。利用的是胶体粒子不可以通过半透膜,溶液中分散质粒子可以通过半透膜。
三、电泳现象
关于电泳现象需要知道:根本原因是胶体粒子带有电荷,因此会在直流电作用下发生定向移动。常见的易错点有/
1.不是所有胶体都有电泳现象,淀粉溶液、蛋白溶液也属于胶体,但是胶体粒子不带电,因此不能产生电泳现象。
2.能发生类似电泳现象的分散系也不一定是胶体。比如常见的氢氧化铁胶体通直流电,阴极附近红色加深。类似的,高锰酸钾溶液通直流电,阳极附近紫色也会变深。这两种现象类似,所以说不能利用电泳现象区分溶液与胶体。
3.结合电泳现象需要知道,胶体本身呈电中性,带电的是胶体粒子,比如氢氧化铁胶体粒子带有正电荷,硅酸胶体粒子带有负电荷。
四、胶体OR胶粒带电?
胶体属于分散系,整体呈现电中性,带电的胶体粒子,但并不是所有的胶体粒子都带电,比如淀粉溶液中的分散质粒子。
如果大家觉得这里的知识对学习有帮助,还请关注Chemy老师,老师会每天更新学习内容,大家也可以查看老师之前发布的学习内容!请点击上方的“关注”吧!