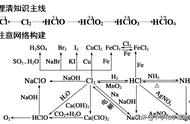
(2)规律:随着原子序数的递增,元素的化合价呈周期性变化,即每周期,最高正价:+1 到 +7(O 无最高正价、F 无正价),最低负价:-4 到-1
例 1.下列 4 种微粒中,半径按由大到小的顺序排列的是( )

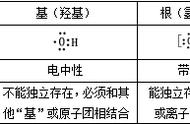
例 2.下图表示 1~18 号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示 ( )

A.电子层数 B.最外层电子数 C.最高化合价 D.原子半径
例 3.下列各组元素的性质递变规律错误的是( )
A.N、O、F 原子最外层电子数依次增加
B.N、O、F 原子半径依次增大
C.Na、Mg、Al 元素最高正化合价依次升高
D.Li、Na、K 的金属性依次增
知识点 2 第三周期元素性质的递变
1.钠、镁、铝元素金属性的递变规律
(1)钠、镁元素金属性的强弱

①该实验加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出, 滴加酚酞溶液变为粉红色。该实验说明镁与冷水几乎不反应,能与热水反应,反应的化学方 程式为 Mg+2H2O===== △ Mg(OH)2+H2↑。
②由上述实验可知,镁和水反应不如钠和水反应剧烈。
(2)镁、铝元素金属性的强弱