这书太厚了,可能会先按短课程的顺序捋一遍,随缘补齐吧,很多我也不懂。还有人说不喜欢这种篇尾链接,想要个哈希表式的目录,那还是等写完吧,谁知道以后会怎么样。
内容和目的现在的有机书中已经包含了很多化合物稳定性的内容。有机分子的张力和稳定性在研究新分子的反应活性,新目标化合物的合成路线,一个新结构的最低能量构象时非常有用。本章的主要目的就是要考察当结构偏离第一章中描述的标准几何构型时导致的能量变化。
这里想多说几句,因为本章大量的物化量化内容,尤其是开头几节,想看的人恐怕不多。书上这一段是对做一线科研的同学说的,对一般的纸上谈兵的同学,这部分的意义就是判断反应方向和中间体,很多时候遇到一个没见过的反应,尤其是重排反应,去问学霸,ta会说:“这是xxx人名反应,你去搜一下。”去问大神,ta会说:“你看这个结构不稳定/不顺眼吧,所以有xxx的反应倾向,于是反应了。”接着问怎么看出不稳定,ta则说是反应看多了,产生的第六感。这种对复杂体系的总结目前有两种思路:
(1)不断归纳已有案例。这其实更适合让AI做,现在真的有用AI来开发新催化剂、新方法学的课题组,当然这个思路更多的还是用在药物研发中,越复杂的体系确实越适合拿来训练,但这样可能会因为很多产率低或副产物多的反应不报道而导致偏差,比如某大学喜欢的von Richter重排,其实产率很低,另外机理因为新实验而被修正也很常见,比如其他书上的经典例子“联苯胺重排”。
(2)从原理出发,本书想讲的就是这个,简化反应体系,尽量从最基础的原理出发,理解分子中的张力和稳定性。
本章首先(2.1)介绍了热力学中的一些基本概念(如张力和稳定性)以及它们的定量表示方法:Gibbs 自由能、焓和熵,请放心,不会讲过多的微积分计算也不会像物化书那样抠概念。由于张力和稳定性与化学键的强度相关,先谈键的解离能的规律,再介绍“热力学基团加和模型”,最后讨论键张力问题。之后用热力学数据讨论了上一章最后的中间体(2.2)。
接下来本章讨论了分子内部运动,考察一些与标准结构参数有更细微变化的结构,主要是构象分析(2.3)。此外,我们还考察了环丙烧这类与标准键参数偏差很大的分子。这个过程中引入物理有机化学中的一个重要概念,即张力能。接着讨论了一些具有特殊结构和能量的分子,它们的成键具有特殊的排布,从而增强了分子的稳定性比如芳香性、异头效应等(2.4),最后考察一些"奇异"的分子的结构(2.5)。
最后谈分子力学(2.6),虽然该方法在理论上具有一定的局限性,但是它对于预测很多有机化合物的结构和能量还是非常有用的。分子力学方法在很多计算化学工具中都是作为"黑箱"来使用,使得人们对它不甚了解。所以会介绍该方法的基本原理以及它的优缺点。
================下面进入本篇2.1的内容=========================
本篇亮点问题:熵和分子结构的联系;ΔG、ΔH、ΔS判断有机化学反应方向时的权重;键解离能的比较,张力的定义。
不要看本篇内容多,其实就是在讲张力能的定义,为了讲这个概念引入了评价分子能量的热力学函数,再介绍了一系列分子能量测定和估算的方法,最后把按稳定分子推算出的估计值和实际值之间的差距归因到结构张力上,推出张力的概念。
因此本篇包含了很多统计热力学和量子力学的内容,这些东西没学过的几乎不可能看懂,学过的看了又得不到什么新知识,所以原本想直接跳过,但看到有初学者想挑战一下,就摘了下来,看看结论也好。总之,不要沉迷在物化和量化中,这些不是重点。
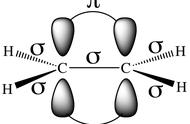
2.1 稳定分子的热力学结构和能量是紧密联系在一起的。任何结构都对应着一个"总能量"或称"内能"。
讨论化学结构的能量时,内能只有在与其他分子比较时才显得重要。
有机分子的能量可以用各种各样的实验值来表示,不同的能量与结构之间存在着明显的系统差异。
2.1.1 内部张力和相对稳定性本节的要点是理解分子能量图,这种图现在的文章中经常会出现,比如下面图这种,它们多是理论计算结果[1]。

上图的纵坐标是“relative Gibbs energy”为什么是相对的呢。因为化学中讨论的张力指存在于分子结构中的应力,而且一定是相对于参照体系而言的。
所有测得的热力学数值都是一个相对数值,必须相对于一个参考态,张力能也如此。存在张力的分子比参照体系具有更高的内能。参照体系可以是一个不存在张力的相同分子的不同构象,或者是不存在张力的另外一个完全不同分子。
内能是分子内部包含的能量。当有一个出路如进行化学反应时该能量可以被部分释放出来。

与势能类似,化学家在画反应坐标示意图和构象分析图时,常常将能量轴标记为PE或E。我们把这样的示意图称为势能图(或势能面) ,它们决定了分子内部的运动或者可能的化学反应。
它们也清楚地诠释了内能相对较高的结构可以释放出能量这种概念。不过我们也常常会采用Gibbs 自由能或焓这些更加明确的概念来定义分子的能量。
上图中弹簧的例子是为了使同学对横坐标“反应或构象分析坐标”有更好的理解,右边再给出一个Sn2反应的例子,体会一下。
分子可以占据不同的量子化能态,这些能态与分子内部的振动和电子状态密切相关。
就像弹簧一样,为了得到具有张力或者高能态的结构,必须增加分子的能量。这些能量可以通过碰撞或捕捉光子获得,也可以在化学合成过程中储存在分子内部。还有一部分能量来自溶液中的热能,它是通过温度来量度的。量子化的不同能态或是具有张力的化学结构的分布都与温度相关。
其他增加分子的能量方法例如,分子吸收红外辐射的光子可以生成具有激发振动模式的高能分子 ,或者吸收紫外线光子可以生成高能电子态。这些方法也都可以增加分子的势能。化学家通常不把这些分子的高能态与张力联系起来,然而两者之间其实是有联系的。

当然分子的变化肯定比弹簧复杂,能量对分子结构的影响是符合Boltzmann 分布的。
总之,当把一个分子画在势能图上的较高位置时,它表示该分子比图中较低位置的参照分子具有更高的内能。化学家称这样的分子为高能的、不稳定的,或是具有张力的。在讨论导致张力或稳定性的因素之前,需要复习一下热力学中的一些基本概念。这样才可以更深刻地理解化学家在研究化学稳定性和张力时所使用的势能形式。
2.1.2 能量的类型本节学过物化可以跳过,没学过的只用看结论,因为真的很无聊。
Gibbs自由能
吉布斯自由能(Gibbs free energy)是在化学热力学中为判断过程进行的方向而引入的热力学函数。
最有名的定义是G = H − TS
而它的微分形式是
dG = − SdT Vdp μdN,我们先讨论更本质的微分形式。
其中μ是化学势,化学势的概念比Gibbs自由能更本质,本书第三章讨论溶液时会仔细讨论化学势的问题,这里先贴一部分第三章的内容。更详细的论述可以参考知乎的一些回答[2]。