从以上的推导能看出Gibbs自由能和化学平衡之间的关系。平衡时,Keq=1,ΔG=0,两边化学势相等达到平衡。甚至能估算出ΔG每增加1.36 kcal/mol,平衡常数上升10倍。
当B的Gibbs 自由能比A低时,从A转化到B是放能的,如果反应开始时A过量,溶液中组分的自发变化过程将朝着生成B的方向进行。相反的,如果B的Gibbs自由能比A高,则该反应是吸能的,考察Gibbs自由能示意图时我们使用这些名词。
从G = H − T*S中我们知道,自由能包括焓(H) 和熵(S) 两个成分。
ΔG、ΔH单位kcal/mol、ΔS单位 eu=kcal/(mol·K),1 kcal=4.184 kJ

焓
焓变是指在恒压不做功的情况下,一个分子集合中两个不同组分之间热量的变化。
焓变和化学键
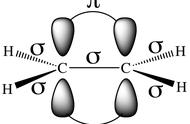
化学反应中热量的变化通常伴随着两种状态间化学键的变化,这种化学键的变化可以是分子内的也可以是分子间的。因此考察始变的最简单方法就是考察相关的化学键强度的变化。
在本章中将会对化学键强度进行深入探讨。事实上,所有关于张力和稳定性的问题都与化学键强度有关。在本章中将给出几种形式的张力的明确定义,它们包括:角张力、扭曲张力、空间张力等,每一种张力都是由于分子中化学键的削弱造成的,它们使得分子变得不稳定。
焓的变化一般用“吸热”和“放热”表示,高中化学知识。
熵
熵是体系混乱度/自由程度的量度。加热通常导致分子更加元序。化学上描述情最简单的方法是把它与各种类型的分子和原子的运动联系在一起,它们被称为自由度。熵比温度更本质,这一点很多物化教程都有精彩的表述。
自由度越大,体系越"松弛”,熵就越大。自由度包括三种类型:平动自由度、转动自由度和振动自由度。
我们还可以从统计学的角度来研究体系的熵。体系存在越多的构型,对熵就越有利。
这里所说的构型可以粗略地理解为分子的不同的几何形状。分子的可能构象越多就越无序。如果构象的能量都相等,熵随着Rlnn 的增加而增加,这里n表示构象的数目。当不同的构型具有不同的能量时,构型与熵的关系就更加复杂。
基础化学中利用键能将焓和分子结构相联系,熵和分子结构的联系又是如何呢?
一个小分子在浓度为1 mol/ L 的情况下,其平动熵约为30 eu 。溶液浓度越高,分子的运动受到的限制就越多,因此熵就越低。
该数值表明在一个反应中使分子失去平功能力需要30 eu 。一个普通的有机分子其转动熵也大约为30 eu,但它与浓度无关。最后,存在于强共价键中的高频振动对分子的熵没有显著的贡献,但低频振动会对熵有一些贡献。分子内化学键的旋转平均贡献3~5 eu ,这表明在化学变化中限制一个可自由旋转的化学键需要3~5 eu。

经验上,冻结一根化学键的旋转,平均需要3~5 eu 。
随着环的增大,环化反应的熵变变得越来越不利。(环己烷是一个特例,相对于所有的链状形式,它的熵变是最不利的。)因为当环增大时,需要冻结更多可旋转的化学键才可以成环。
ΔG ΔH ΔS判断化学反应方向时的权重
焓为主、ΔG决定、熵为辅。这就是高中化学强调焓变的原因。
虽然熵在化学结构发生显著变化(如环化)时非常重要,但是当比较两个相似的结构时,熵变通常很小。由于这个原因,热力学中的讨论主要都集中在焓变上。通常在讨论两个或多个结构的相对稳定性时只考虑焓变的数值就足够了,因为其值在相似的结构中也会有很大的变化。但是必须记住ΔG才是平衡常数的决定因素。只有当焓变的差异非常小时,才需要考虑熵的变化。
2.1.3 键解离能定义: