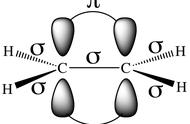
注意是“均裂”形成两个自由基,异裂出质子是在酸碱中讨论的。

由于BDE可以表示化学键的强度,在一个分子中比较不同化学键的BDE数值就可以知道它们的强弱。对于两个化学键数目和类型都相同的分子,如果假设它们之间熵的差异不是很大,那么通过比较两个分子总的BDE值就可以知道哪一个分子更稳定。
BDE还反映了化学键的本质,所以化学键模型也应该能够解释不同化学键的解离能的不同。
规律和其他热力学数据的类似:
CH3—X中,-F>-OH>-NH2,电负性是主要因素。
结合上一章的内容,我们知道键长越短,键就越强。
对于卤素而言,是-F>-Cl>-Br>-I。这个不仅和电负性相关,也和键长、轨道重叠相关。
杂化的影响:C(sp)-H>C(sp2)-H>C(sp3)-H。上一章的解释同样适用,s轨道成分越大,基团的电负性就越大,键长就越短。
有机化学中常把饱和碳链看成是惰性的,数据上看C-C和C-H 键的BDE通常都大于85 kcal/ mol 。和其他化学键相比确实非常稳定。相比过氧甲醚的O-O键,BDE 仅为38 kca l/ mol,差距确实非常大 。
再举表里的一个例子:

很明显是共轭对自由基的影响,上一章已经讨论过,但这个问题很容易想到芳香性问题上,只能说不要想太多。
水分子中的O-H 键是最强的化学键之一,其BDE 为119 kcal/ mol 。由于在自由基反应中热力学数据往往反映了反应活性,羟基自由基(HO·)具有非常强的反应活性因此也不足为奇。在反应:
HO· R-H → H2O R·
中,对于几乎所有的有机化合物RH ,该反应都应该是一个放热反应,并且反应速率很快。
羟基自由基公认是生物系统中最具活性的活性氧物种,它在很多生命物质中都存在并且参与很多生物化学反应,同时有可能能导致生物体内DNA,蛋白质和脂质氧化损伤。
使用BDE 预测反应的放热性和吸热性

这个在大学化学里应该是基础知识了,就不多说了。注意不同的方法测得的BDE 值会有一些差异,最后不要用不同文献中的数据计算。
2.1.4 势能函数和势能面简介——键伸缩本节将涉及大量的量子力学内容,没学过的可以只看结论,学过的可以直接跳过。
本段其实想讲的是:熵和键解离能(化合物性质)——键伸缩模型(理论模型)——红外光谱(测试方法),结果花了大功夫讲了一个量子力学模型,不知道意义何在,但我还是摘录了下来,并补了一些概念。
对于一个简单分子,定义BDE 的化学键均裂反应可以与分子的某个简正模式联系起来。简正模式是分子具有的振动自由度,包括伸缩、弯曲、摇摆、扭曲等,每一项都有它们各自的基频。分子的结构并不是静态的,而是动态的。每一种基频都可以用一个势能函数所描述。