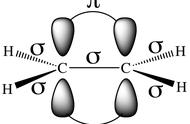
注意以上公式[3]中的
E =E(S,V,N)
dE = TdS - pdV μdN
也就是说,一个体系的能量U或者说E,不考虑其他因素,可以写成E(S,V,N),也就是说它是熵S(混乱度)、V(体积)、N(粒子数)的函数,这三个都是广延变量,简单说就是可以叠加的。从微观角度上说,不考虑磁场、电场等外界因素,体系的能量是粒子的数量、混乱度、所占体积的函数。
E对S、V、N的偏导则是强度变量。我们定义E对S的偏导就是温度T、对V的偏导是压强p,对N的偏导是化学势μ,这三个量不能相加(强度变量)。它们的作用就是“评价强弱”,对于一般体系而言则可以反应体系的“方向”。
"方向"指什么呢?
高温的A和低温的B接触,发生能量交换,能量自发地从A流向B(热交换),直至温度T相同时达到平衡;高压的A和低压的B进行体积交换,能量自发由A流向B(体积功),直到压力p相同时达到平衡;A和B发生粒子交换,类似T和p,可以定义一个量“化学势”,用来判断粒子交换是否达到平衡和能量变化的“方向”。这就是化学势的意义。
化学势和Gibbs自由能的关系有时怎样的呢?
化学势和活度以及浓度的关系如下,这段物化书上有,就直接截图了,其中 RT ln[ ]大家应该很熟悉了。

对于A和B之间的反应而言:

由上面Gibbs自由能微分式的定义,很容易推出以下的公式。

其中反应进度ξ是用来描述某一化学反应进行程度的物理量,量纲为mol反应,相当于dN。
所以得到了