H2O
【解析】滤液2调节pH的目的是提高溶液的酸性,pH变小;因为溶液中存在2CrO42− 2H

【练习】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

根据H3BO3的解离反应:H3BO3 H2O

【答案】一元弱 转化为H3BO3,促进析出
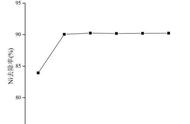
【解析】由硼酸的离解方程式知,硼酸在水溶液中是通过与水分子的配位作用产生氢离子,而三价硼原子最多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液pH调节至3.5,目的是将B(OH)−4转化为H3BO3,并促进H3BO3析出
【练习】碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下: