已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为______ _________;
【答案】溶液酸性过强,TeO2会继续与酸反应导致碲元素损失
【解析】TeO2能溶解于较浓的强酸性或强碱性溶液,故“加压浸出”时控制溶液pH为4.5~5.0,的酸性不能过强,否则TeO2会继续与酸反应导致碲元素损失
【2018全国Ⅲ节选】利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“调pH”中发生反应的化学方程式为 。
【答案】KH(IO3)2 KOH = 2KIO3 H2O
【解析】根据图示,碘酸钾在最后得到,所以过滤时KH(IO3)2应该在滤渣中,所以滤液中主要为KCl。“调pH”的主要目的是将KH(IO3)2转化为KIO3,所以方程式为:KH(IO3)2 KOH = 2KIO3 H2O。
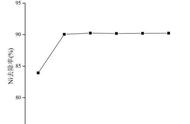
【练习】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性。工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:Ⅰ.钒有多种价态,其中 5价最稳定。钒在溶液中主要以VO