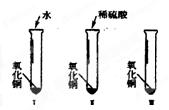
NH4 +OH- Kb=1.8×10-5
H2C2O4

H +HC2O4- Ka1=5.4×10-2
HC2O4-

H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH______7(填">"或"<"或"=")。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600 ℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是________。

【答案】 ⑴ 将Co3 、Fe3 还原为Co2 、Fe2 (只要回答到将Co3 还原为Co2 均给分,);
⑵ ClO3-+6Fe2 6H = Cl-+6Fe3 3H2O
⑶ <
⑷ A
⑸ 除去溶液中的Mn2 B
⑹ Co2O3
【解析】(1)亚硫酸钠具
有还原性,能还原氧化性离子Fe3 、Co3 ,所以浸出过程中加入Na2SO3的目的是将Fe3 、Co3 还原,还原为Fe2 、Co2 ;
(2)NaClO3具有氧化性,能将浸出液中的Fe2 氧化成Fe3 ,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3- 6Fe2 6H =6Fe3 Cl- 3H2O;
(3)盐类水解,谁强显谁性,NH3•H2O⇌NH4 OH- Kb=1.8×10-5,HCO4-⇌H C2O42- K a2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7;
(4)为除去(NH4)2C2O4 晶体表面的附着液,洗涤时可选用蒸馏水洗涤,这样可得到更纯净的晶体,故答案为A;
(5)根据流程图可知,此时溶液中存在Mn2 、Co2 金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,答案为B,可使Mn2 完全沉淀,并防止Co2 转化为Co(OH)2沉淀;
(6)由图可知,C点钴氧化物质量为8.03g,0.1molCo元素质量为5.9g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol: