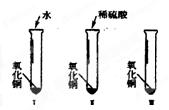
≈2:3,故C的Co氧化物为Co2O3。【题型】填空题
【难度】一般
4.由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子占有的原子轨道数为___个,P、S、Cl的第一电离能由大到小顺
序为_______。
(2)PCl3分子中的中心原子杂化轨道类型是______,该分子构型为_______。
(3)PH4Cl的电子式为______ ,Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为________。
⑷己知MgO与NiO的晶体结构(如图1)相同,其中Mg2 和Ni2 的离子半径分别为66 Pm和 69 pm,则熔点:MgO___NiO(填">"、"<"或"="),理由是______。

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
(6)一定温度下,NiO晶体可以自发地分散并形成"单分子层",可以认为O2-作密置单层排列, Mi2 填充
其中(如图2),己知O2-的半径为a m,每平方米面积上分散的该晶体的质量为____g。(用a、NA表示)
【答案】⑴ 9 Cl> P > S
⑵ sp3 三角锥形


⑶ 1∶1
⑷ > Mg2 半径比Ni2 小,MgO的晶格能比NiO大
⑸ (1,1/2,1/2)
⑹