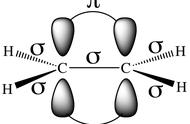
设置燃烧热是因为生成热不好测。
在比较两种或多种同分异构体化合物时,生成热负值越大表明化合物越稳定。
燃烧热负值越大表明化合物越不稳定,其分子内张力也越大。
由表达式可以知道:
对于A→B
反应焓=A的燃烧焓-B的燃烧焓=B的生成焓-A的生成焓
生成焓可以是正的,热力学不稳定的化合物很常见。
我们必须清楚地了解热力学稳定性和动力学稳定性之间的差别:
热力学稳定性与特定的平衡位置相关,它是通过ΔGΘ来衡量的。
动力学稳定性与反应速率有关,所以控制它的不是ΔGΘ,而是ΔG≠。如果一个分子所有可能发生的反应都存在很高的活化能壁垒,则该分子在动力学上是稳定的。下面这张图是从March里找的,动力学稳定热力学不稳定的例子,比如过氧化氢。


在起初的一些波动之后,规律逐渐显现出来:在正烷烃上每增加一个CH2 基团生成焓平均增加-4.93 kca l/ mol ,该规律暗示了基团加和的概念。

Cd=双键上的碳原子;CB = 苯环上的碳原子;NI= 亚胺上的氮原子。这个表的数据也被称为Benson 增量。
Benson基团加成法对于反应机理的研究, 用来估算分子生成热的可信方法极为重要。
比如,如果算出的一个分子的生成焓超过了一个反应的活化焓与反 应物的生成焓之和,那么,这个分子就不可能是这个反应的中间体。
这个表仔细读会觉得奇怪,因为经计算和验证后发现仅有双原子体系的信息是不够的。很明显并非所有的C-H键都是一样的,于是通过增加基团中原子的数目避免这种情形发生。
所以变成了[某原子]—[相连的原子1]n[相连的原子2]m……这种形式。
这表要细谈可以讲很久,简单介绍的话举个例子: