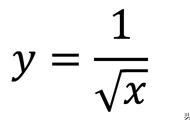第二个峰可能在与OmCI结合后得到稳定,效果较小。峰下面积对应于展开的焓,保持基本相同,与使用的OmCI构造的亲和力的关系不如主峰的稳定性清晰。
OmCI突变体本身通常比WT OmCI的热稳定性较低。最不稳定的OmCI突变是M134G,其次是R47A和E141A。其余的突变体在ΔTm上相对较小,小于-3°C。单个R47A和E141A突变是最不稳定的突变之一,E141A/R47A双突变体比WT OmCI更具热稳定性。
在第二次熔化之前进行了一轮冷却,以评估蛋白质在变性后的重新折叠能力。峰下面积对应于展开的焓(ΔH),两个峰的比率,可以计算出ΔΔH或折叠百分比。作为一个具有许多二硫键的大型复杂蛋白质,C5无法重新折叠,一部分OmCI可以恢复。

在几乎与第一个周期相同的Tm下再次熔化。WT OmCI的恢复率约为72%,突变体的恢复率为47-69%。与CD数据一致,M134G突变体在重新折叠方面基本无法恢复,只有24%的蛋白质恢复。
在单周期动力学实验中拟合数据时的观察,寻求进一步证据证明C5-OmCI相互作用中的复杂结合动力学。为了获得更详细的动力学数据进行分析,进行了SPR的多周期动力学实验。
多周期动力学在一个周期内执行单一样品浓度的单次注射,在每次注射后再生表面以解离结合物质。为了排除固定步骤中的异质性,使用连接到N-末端AVI标签的生物素均匀固定了OmCI,使其取向固定。

这些数据单一结合位点模型解释,拟合kon产生了基本可接受的标准误差值。结合时的折射率变化并未表明结合物质的摩尔比超过1:1。与单周期实验一致,单一结合位点模型再次似乎低估了低浓度下的kon,在高浓度下则高估了kon。
这表明单周期动力学实验中的观察结果并非是由于对传感器芯片的异质性固定所致,可能表明OmCI-C5结合相互作用中存在额外的复杂性。
报告了突变体OmCI蛋白与C5结合的单个速率常数和KD值。WT蛋白表现出类似抗体的亲和力,超过了SPR准确测定koff的1.0E-5 s^-1的限制。WT OmCI的KD值<100 pm,至少比以前报道的低10倍。

E141A单突变显示出>7倍的亲和力降低(KD为0.7 nm),E141A/H164A双突变显示出>40倍的亲和力降低(KD为4 nm)。与WT相比,E141A/R47A双突变显示出>130倍的亲和力降低(KD为13 nm)。这些亲和力的降低是通过koff值的增加来介导的。
在一种替代途径(AP)激活ELISA中测试了突变体,以确定亲和力缩减形式的OmCI能够抑制MAC的形成程度。单突变体和WT OmCI是强效抑制剂,显示出陡峭的希尔斯坡,表明它们已经达到了试验的紧密结合限制。
双突变体E141/R47A和E141A/H164A分别显示出>10倍和>5倍的效力下降。效力有所变化,所有的突变体都能够在足够高的浓度下有效地抑制MAC的形成。