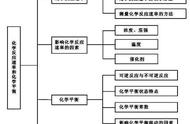
【知识回顾】根据学案复习回顾外界条件对化学平衡移动的影响。
1.温度对化学平衡的影响:升高温平衡向 反应方向移动;降低温度,平衡向 放热反应方向移动。
2.浓度对化学平衡的影响:增大生成物浓度或减小反应物浓度,平衡向 方向移动,减小生成物浓度或增大反应物浓度,平衡向 方向移动。
3.压强对化学平衡的影响:增大压强,化学平衡向 方向移动,减小压强,化学平衡向 方向移动。
【联想质疑】 根据有关计算可知,在常温、常压下,反应∶2H2(g) O2(g)=2H2O(1)
其化学平衡常数的数量级高达1083,表明反应正向进行的趋势极大。但是,在常温、常压下,即使经过几千年,氢气和氧气的混合气也不会发生反应生成水,而将混合气点燃时反应却在爆鸣声中瞬间完成。这说明,在研究化学反应时,只关注反应的方向和限度是不够的,还要考虑化学反应的速率。
【投影】

【质疑】化学反应速率是描述化学反应快慢的物理量,实验证实,反应条件的改变会影响化学反应的速率。那么,化学反应为什么会有快有慢?化学反应是怎样进行的?怎样定量地表示化学反应速率?反应条件是怎样影响化学反应速率的?
【讲述】首先我们来了解一下化学反应为什么会有快有慢?化学反应是怎样进行的?
【交流研讨】学生阅读教材所给材料,针对以下问题与同学们交流研讨。
1.你对"化学反应是怎样进行的"这个问题有哪些认识?
2.造成化学反应速率千差万别的原因是什么?
【板书】一.化学反应是有历程的
【投影】氢气和氧气的混合气体在点燃或有催化剂存在的条件下,反应的主要历程∶

【讲述】大多数化学反应都是分几步完成的,其中能够一步完成的反应称为基元反应。
基元反应构成的反应序列称为反应历程,反应物一步直接转化为生成物的,总反应就是基元反应,这类反应又称为简单反应。
【投影】反应历程——基元反应构成的反应序列(又称反应机理)
总反应——基元反应的总和
复杂反应——由几个基元反应组成的总反应
简单反应——反应物一步直接转化为生成物的,总反应就是基元反应。
【讲述】复杂反应的化学方程式是总反应的化学方程式,它只能表示出反应物和生成物以及它们之间的化学计量关系,不能表示反应历程。反应不同,反应历程就不相同;同一反应在不同条件下的反应历程也可能不同。反应物的结构和反应条件决定着一个反应的反应历程,而反应历程的差别又造成了化学反应速率的不同。
【拓展视野】 化学反应是如何进行的?长期以来,一直是个谜。飞秒化学是以飞秒为时间标度研究化学反应详细过程的化学前沿领域。请同学们阅读“拓展视野”内容,了解什么是飞秒化学。
【引入】化学反应历程的不同,造成了化学反应速率的不同,如何定量的描述化学反应的快慢呢?请大家完成“活动探究”内容。
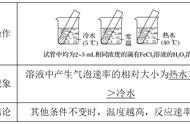
【活动探究】 截取三根镁条,分别称重,再让它们分别与浓度不同的过量盐酸反应(注意∶实验要在通风条件下完成),记录镁条完全消失所用的时间t,将结果填入下表中。
c(HC1)/(mol·L-1)
2.0
1.5
1.0
m(Mg)/g
n(Mg)/mol
t/min
反应速率v
【思考交流】根据实验结果,小组思考交流以下问题:
1.根据所得实验数据,你认为应该怎样表示该化学反应的速率?请将计算结果填入表中。
2.如果分别用单位时间内盐酸浓度的减小、氯化镁浓度的增大来表示该化学反应的速率,需要哪些数据?二者在数值上相等吗?为什么?
3.盐酸浓度的改变对该化学反应的速率产生了怎样的影响?
【板书】二.化学反应速率
【展示】小组展示交流研讨结果
【总结】对于一个化学反应我们可以用单位时间内某物质浓度、质量或物质的量等的改变量(取绝对值)来表示该物质的化学反应速率。通常我们用单位时间内物质浓度的变化量来描述化学反应的快马。且对于一个具体的化学反应,用不同的反应物或生成物表示的化学反应速率的数值往往不相同,用各物质表示的化学反应速率的数值之比等于化学方程式中各物质化学式前的系数之比。
【投影】二.化学反应速率
1.含义:描述化学反应进行快慢的物理量。
2.表示方法
(1)对于反应体系体积不变的化学反应,可以用单位时间内
某物质浓度(或质量、物质的量等)的改变量(取绝对值)来表示该物质的化学反应速率。
(2)表达式:v=

3.常用单位:mol·L-1·s-1 、mol·L-1·min-1
【迁移应用】在密闭容器中,合成氨的反应,刚开始时氮气为8mol/L与氢气的浓度为20mol/L,5min后,测得容器内剩余的氮气的浓度为6mol/L。计算用N2、H2、NH3的浓度变化表示的反应速率分别为多少?
【板演】一名学生板演,其余学生在练习本上完成。
【展示】